题目内容
30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )
| A、c(H+)?c(OH-)<1×10-14 |
| B、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.30℃时,水的离子积>1×10-14;
B.根据Na2S、NaHS两溶液中的物料守恒判断;
C.根据Na2S、NaHS两溶液中的质子守恒判断;
D.溶液中一定满足电荷守恒,根据Na2S、NaHS两溶液中的电荷守恒判断.
B.根据Na2S、NaHS两溶液中的物料守恒判断;
C.根据Na2S、NaHS两溶液中的质子守恒判断;
D.溶液中一定满足电荷守恒,根据Na2S、NaHS两溶液中的电荷守恒判断.
解答:
解:A.常温时,c(H+)?c(OH-)=1×10-14,温度升高促进水的电离,则30℃时,c(H+)?c(OH-)>1×10-14,故A错误;
B.根据物料守恒:在0.1mol?L-1的Na2S溶液中存在:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S),故B错误;
C.根据质子守恒:在0.1mol?L-1的Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(OH-)=c(H+)+c(H2S),故C错误;
D.从溶液呈电中性的角度分析,两溶液中均存在:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故D正确.
故选D.
B.根据物料守恒:在0.1mol?L-1的Na2S溶液中存在:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S),故B错误;
C.根据质子守恒:在0.1mol?L-1的Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(OH-)=c(H+)+c(H2S),故C错误;
D.从溶液呈电中性的角度分析,两溶液中均存在:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故D正确.
故选D.
点评:本题考查溶液中离子浓度的大小比较,题目难度中等,易错点为CD,注意比较两溶液的水解情况,把握物料守恒和质子守恒的运用.

练习册系列答案
相关题目
下列说法中,错误的是( )
| A、向Na2SiO3溶液中通入CO2产生白色胶状沉淀 |
| B、NaOH溶液不能存放在磨口玻璃塞的试剂瓶中 |
| C、二氧化硅溶于水生成硅酸 |
| D、二氧化硅是一种熔沸点很高、硬度很大的氧化物 |
下列物质属于弱电解质的是( )
| A、氯化钠 | B、蔗糖 | C、醋酸 | D、硫酸 |
下列各组中两种物质发生变化时,所克服的作用力属于同种类型的是( )
| A、二氧化硅和氯化镁熔化 |
| B、碘和氯化铵受热变成气体 |
| C、钠和硫受热变成气体 |
| D、氯化钠和硝酸钠溶于水 |
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、1mol Na2SO4溶于水中,所得溶液中Na+个数为NA |
| B、18g水含有电子数为8NA |
| C、标准状况下,22.4L氢气含有氢原子个数为2NA |
| D、22.4L氢气一定含有NA 个氢分子 |

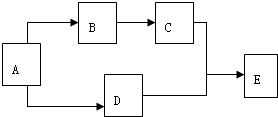 有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:
有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题: