题目内容
17.电子表和电子计算器中所用的是纽扣式的微型银锌电池;其电极分别为Ag2O和Zn,电解液为KOH溶液,工作时电池总反应为:Ag2O+Zn═2Ag+ZnO(1)工作时,电流从Ag2O(填Ag2O或Zn,下同)极流向Zn极.
(2)该电池中正极发生还原(填氧化、还原)反应; 负极发生的电极反应方程式为:Zn+2OH-=Zn(OH)2+2e-
(3)工作时溶液中OH-向Zn(填Ag2O或Zn)极移动,电池正极区的PH增大(填“增大”“减小”或“不变”)
分析 根据化合价变化可知Zn被氧化,应为原电池的负极,电极反应为Zn+2OH-=Zn(OH)2+2e-,则正极为Ag2O,被还原,电极反应为Ag2O+H2O+2e-=2Ag+2OH-,结合电极方程式解答该题.
解答 解:(1)在反应Ag2O+Zn+H2O═2Ag+Zn(OH)2中,由化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,电子由负极流向正极,电流流向与电子流向相反,故答案为:Ag2O;Zn
(2)正极发生还原反应,负极的电极反应式为:Zn+2OH-=Zn(OH)2+2e-,故答案为:还原;Zn+2OH-=Zn(OH)2+2e-;
(3)阴离子向负极移动,正极的电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-,导致正极附近氢氧根离子浓度增大,溶液的pH值增大,故答案为:Zn;增大.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.

练习册系列答案
相关题目
2.下列说法不正确的是( )
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 反应物的总能量低于生成物的总能量时,发生吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
6.常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,则x与y之和可能是( )
| A. | x+y=5 | B. | x+y=7 | C. | x+y=11 | D. | x+y=13 |
7.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | SO3 | B. | FeCl2 | C. | Na2O2 | D. | NH3 |
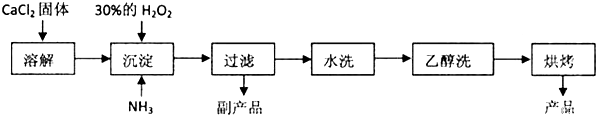
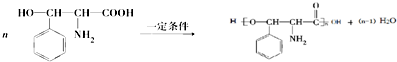 .
.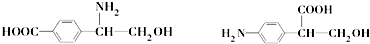
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)△H<0
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)△H<0 FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.
FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.