题目内容
18.NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.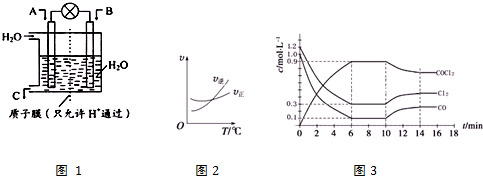
(1)如图1所示,利用电化学原理将NO2 转化为重要化工原料C.若A为NO2,B为O2,则负极的电极反应式为:NO2+H2O-e-=NO3-+2H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)制备.图2为此反应的反应速率随温度变化的曲线,图3为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题:
①0~6min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1;
②若将初始投料浓度变为c(Cl2)=0.9mol/L、c(CO)=0.7mol/L、c(COCl2)=0.3 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③随温度降低,该反应平衡常数变化的趋势是增大;(填“增大”、“减小”或“不变”)
④比较第9min反应温度T(9)与第16min反应温度T(16)的高低:T(9)<T(16)(填“<”、“>”或“=”).
⑤比较第9min反应速度V(9)与第16min反应温度v(16)的高低:v(9)<v(16)(填“<”、“>”或“=”).
分析 (1)NO2 在负极失去电子转化为NO3-,根据电极反应式的书写方法来回答;
(2)应用盖斯定律解题,始终抓住目标反应和已知反应之间的关系应用数学知识来解;
(3)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,根据v=$\frac{△c}{△t}$计算v(Cl2);
②改变初始投料浓度变,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,则为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L;
③由图2可知,升温平衡向逆反应方向移动,平衡常数减小;
④根据图象,第9min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由③升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动,故T(9)<T(16);
⑤温度越高反应速率越快.
解答 解:(1)NO2 在负极失去电子转化为NO3-,故其电极反应为:NO2+H2O-e-=NO3-+2H+,故答案为:NO2+H2O-e-=NO3-+2H+;
(2)应用盖斯定律解题,△H=-△H1-△H2+$\frac{3}{2}$△H3+2△H4=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)=$\frac{0.9mol/L}{6min}$=0.15 mol•L-1•min -1,
故答案为:0.15 mol•L-1•min -1;
②最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,即与开始平衡为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L,则:0.9mol/L+c(COCl2)=1.2mol/L,c(CO)=0.7mol/L+c(COCl2)=1.0mol/L,故c(COCl2)=0.3mol/L,
故答案为:0.3;
③由图1可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,随温度降低,该反应平衡常数变化的趋势是增大,故答案为:增大;④根据图象,第9min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由③升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动,故T(9)<T(16),故答案为:<;
⑤温度越高反应速率越快,而④可知,T(9)<T(16),所以v(9)<v(16),故答案为:<.
点评 本题考查热反应方程式、化学平衡计算、化学平衡影响因素、化学平衡常数、反应速率计算等,侧重考查学生对图象与数据的分析及计算能力,难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有8种 | |
| D. | 该烃是苯的同系物 |
| A. | 实验室可用电石与蒸馏水制乙炔 | |
| B. | 苯与液溴反应时,要加入铁粉,所以真正起到催化作用的是铁粉 | |
| C. | 石油裂化的目的是为了提高汽油的产量和质量 | |
| D. | 说明苯分子中的碳碳键不是单、双键交替的事实是苯的邻位二取代物只有一种 |
| A. | ClCH2COOH的酸性比CH3COOH酸性强 | |
| B. | 苯酚能与NaOH溶液反应而乙醇则很难 | |
| C. | HOOCCH2CHO既能发生银镜反应又能发生酯化反应 | |
| D. | 丙酮(CH3COCH3)中的氢原子比乙烷中的氢原子更易发生卤代反应 |
| A. |  | B. |  | C. |  | D. |   |
| A. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 | |
| B. | 甲烷、苯、乙酸都可以发生取代反应 | |
| C. | 标况下,1mol 乙醇可与足量的Na反应生成22.4LH2 | |
| D. | 乙酸可与Na2CO3溶液反应生成CO2 |
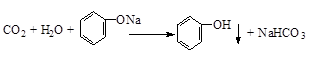 .
.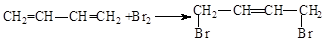 .
.