题目内容
露置的苛性钾经分析含H2O:7.62%,K2CO3:2.38%,KOH:90%,将此样品1g放入1mol?L-1盐酸46mL中,过量的酸用1.070mol?L-1 KOH中和至中性,蒸发中和后的溶液可得固体( )
| A、4.00g | B、3.43g |
| C、4.50g | D、无法计算 |
考点:化学方程式的有关计算
专题:计算题
分析:K2CO3、KOH和稀盐酸反应生成KCl,剩余的HCl用KOH中和至中性,最终溶液中的溶质为KCl,蒸发中和后的溶液得到的固体是KCl,根据Cl原子守恒计算固体质量.
解答:
解:K2CO3、KOH和稀盐酸反应生成KCl,剩余的HCl用KOH中和至中性,最终溶液中的溶质为KCl,蒸发中和后的溶液得到的固体是KCl,根据Cl原子守恒得n(HCl)=n(KCl)=1mol/L×0.046L=0.046mol,m(KCl)=0.046mol×74.5g/mol=3.43g,
故选B.
故选B.
点评:本题考查物质的量的计算,明确得到固体成分是解本题关键,再结合原子守恒解答,同时考查学生分析问题能力,化繁为简,题目难度不大.

练习册系列答案
相关题目
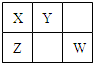 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,其中X原子最外层电子数是其电子层数的2倍.下列说法正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,其中X原子最外层电子数是其电子层数的2倍.下列说法正确的是( )| A、四种元素的原子半径大小rY>rW>rX>rZ |
| B、元素X的含氧酸只有一种,元素Y则有两种 |
| C、元素Z的气态氢化物的稳定性比元素Y的强 |
| D、元素Y和W的氧化物是导致酸雨的主要原因 |
将50mL 0.5mol/L的Al2(SO4)3溶液加入4.0mol/L NaOH溶液可得到2.34g沉淀.则消耗的NaOH溶液的体积可能是( )
| A、45ml | B、30ml |
| C、42.5ml | D、60ml |
工业炼铁的原料包括铁矿石、焦炭和足量的空气.某种铁矿石中所含有效成分为Fe2O3和Fe3O4.某次炼铁,矿石中含这两种铁氧化物共1.0吨,假定焦炭与矿石均被充分利用,所需焦炭的质量可能是( )
| A、0.22吨 |
| B、0.21吨 |
| C、0.11吨 |
| D、0.10吨 |
将含有2molKAl(SO4)2的溶液和含有3.5molBa(OH)2的溶液混合,则下列说法正确的是( )
| A、反应后溶液呈碱性,且溶液中OH-的物质的量为1mol |
| B、反应后,铝元素的存在形式有Al(OH)3和AlO2-,且物质的量分别为1mol、0.5mol |
| C、反应后溶液中有K2SO4和KAlO2两种溶质 |
| D、反应中生产沉淀Al(OH)3和BaSO4的物质的量分别为2mol、3.5mol |