题目内容
粗盐中含有泥沙和杂质离子:Mg2+、Ca2+、SO42-,请设计方案提纯.
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:粗盐常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,提纯NaCl的流程如下:(加入的试剂稍过量)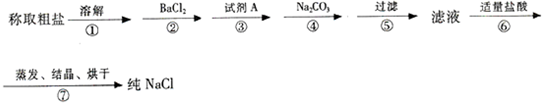 (其中A为NaOH),实验中镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠,最后经蒸发、结晶烘干可得到纯净的氯化钠.
(其中A为NaOH),实验中镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠,最后经蒸发、结晶烘干可得到纯净的氯化钠.
 (其中A为NaOH),实验中镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠,最后经蒸发、结晶烘干可得到纯净的氯化钠.
(其中A为NaOH),实验中镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠,最后经蒸发、结晶烘干可得到纯净的氯化钠.解答:
解:粗盐常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠,
BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸制不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH),
答:可先加入BaCl2除去SO42-,再加入NaOH除去Mg2+(二者顺序可颠倒),然后加入过量的Na2CO3溶液,充分反应后过滤,在滤液中加入盐酸,经反应后加热、蒸发、结晶可得到纯净的氯化钠.
BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸制不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH),
答:可先加入BaCl2除去SO42-,再加入NaOH除去Mg2+(二者顺序可颠倒),然后加入过量的Na2CO3溶液,充分反应后过滤,在滤液中加入盐酸,经反应后加热、蒸发、结晶可得到纯净的氯化钠.
点评:本题考查较为综合,涉及物质分离提纯、除杂以及离子检验等知识,为高频考点,把握除杂不能引入新的杂质及试剂的添加顺序为解答的关键,注意除杂试剂过量,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
在105℃时1L两种气态混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10.5L,再将气体通过碱石灰,体积缩小6L.则下列各组混合烃中符合此条件的是( )
| A、CH4,C4H8 |
| B、CH4,C4H10 |
| C、C2H4,C3H8 |
| D、C2H2,C4H10 |
露置的苛性钾经分析含H2O:7.62%,K2CO3:2.38%,KOH:90%,将此样品1g放入1mol?L-1盐酸46mL中,过量的酸用1.070mol?L-1 KOH中和至中性,蒸发中和后的溶液可得固体( )
| A、4.00g | B、3.43g |
| C、4.50g | D、无法计算 |
将H2通过10gCuO粉末加热片刻,冷却后剩余固体的质量为8.4g,那么下列计算正确是( )
| A、有1.6g H2O生成 |
| B、有8.4g Cu生成 |
| C、有80%的CuO被还原 |
| D、实验过程中所消耗的氢气为0.2g |
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中正确的是( )
| A、用蒸馏水冼净滴定管后,即装入标准盐酸进行滴定 |
| B、用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 |
| C、用碱式滴定管取10.00mLNaOH溶液放入洁净的锥形瓶中,再加入适量蒸馏水后进行滴定 |
| D、改用量筒量取10.0mLNaOH溶液,放入锥形瓶后进行滴定 |
 一定条件下,在一个3L密闭容器中发生如图反应:
一定条件下,在一个3L密闭容器中发生如图反应: