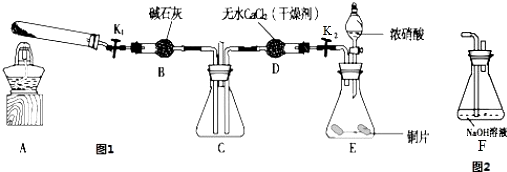
题目内容
4.下列化学用语表示不正确的是( )| A. | 钠离子的结构示意图: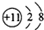 | |
| B. | 氢氧根离子的电子式: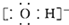 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
分析 A、钠离子的核外有10个电子,核内有11个质子;
B、氢氧根中氧原子和H原子间以共价键结合;
C、氯原子有17个质子,而质量数=质子数+中子数;
D、氧化钠和过氧化钠均由2个钠离子和1个阴离子构成.
解答 解:A、钠离子的核外有10个电子,核内有11个质子,故钠离子的结构示意图为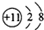 ,故A正确;
,故A正确;
B、氢氧根中氧原子和H原子间以共价键结合,故氢氧根的电子式为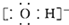 ,故B正确;
,故B正确;
C、氯原子有17个质子,而质量数=质子数+中子数,故氯原子的质量数为37,故为${\;}_{17}^{37}$Cl,故C正确;
D、氧化钠和过氧化钠均由2个钠离子和1个阴离子构成,故氧化钠和过氧化钠中阳离子和阴离子的个数之比均为2:1,故D错误.
故选D.
点评 本题考查了离子的结构示意图、电子式的书写和物质的构成,难度不大,应注意的是过氧化钠由2个钠离子和1个过氧根构成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列关于中和滴定的操作错误的是( )
| A. | 滴定前需要检查滴定管是否漏水 | |
| B. | 用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶 | |
| C. | 滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,会使滴定结果偏高 | |
| D. | 用已知浓度盐酸滴定未知浓度的NaOH溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低 |
12.对于反应N2(g)+3H2(g)?2NH3(g) 来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(H2)=0.8mol/(L•s) | B. | v(N2)=0.4mol/(L•s) | ||
| C. | v(NH3)=0.6mol/(L•s) | D. | v(H2)=4.2mol/(L•min) |
19.X、Y、Z、W是元素周期表中短周期元素,四种元素在元素周期表中的位置关系如图,如果它们都属于中学化学重点研究的对象,则下列说法中不正确的是( )
| X | Y | ||
| Z | W |
| A. | 同价态氧化物的沸点:Z>X | |
| B. | 单质的氧化性:W>Z | |
| C. | Y和W可以同时存在于同一离子化合物中 | |
| D. | 它们都只能形成一种气态氢化物 |
16.为测定硫酸亚铁铵晶体【(NH4)2Fe(SO4)2•xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、溶解、转移、洗涤并转移、定容、摇匀.
(2)用酸式(“酸式”或“碱式”)滴定管盛放KMnO4溶液.
(3)当滴入最后一滴KMnO4溶液,出现溶液由黄色变成紫红色,且半分钟内不褪色,即到达滴定终点.反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(4)滴定结果如表所示:
实验测得该晶体中铁的质量分数为11.20%.(保留两位小数)
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、溶解、转移、洗涤并转移、定容、摇匀.
(2)用酸式(“酸式”或“碱式”)滴定管盛放KMnO4溶液.
(3)当滴入最后一滴KMnO4溶液,出现溶液由黄色变成紫红色,且半分钟内不褪色,即到达滴定终点.反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(4)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
13.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)元素化学性质最不活泼的是Ne,氧化性最强的单质是F2.
(2)最高价氧化物的水化物碱性最强的是NaOH,最高价氧化物的水化物呈两性的是Al(OH)3,它们之间反应的离子方程式为Al(OH)3 +OH-═AlO2-+2H2O.
(3)A分别与E、G、H形成的化合物中,最稳定的HF.
(4)用电子式表示 B、H组成的化合物的形成过程 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,最高价氧化物的水化物呈两性的是Al(OH)3,它们之间反应的离子方程式为Al(OH)3 +OH-═AlO2-+2H2O.
(3)A分别与E、G、H形成的化合物中,最稳定的HF.
(4)用电子式表示 B、H组成的化合物的形成过程
 .
.
14.当今大量致冷剂的使用和排放,使大气臭氧层受到严重破坏,这种致冷剂是( )
| A. | 干冰 | B. | 液氧 | C. | 液氨 | D. | 氟利昂 |