题目内容
13.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,最高价氧化物的水化物呈两性的是Al(OH)3,它们之间反应的离子方程式为Al(OH)3 +OH-═AlO2-+2H2O.
(3)A分别与E、G、H形成的化合物中,最稳定的HF.
(4)用电子式表示 B、H组成的化合物的形成过程
 .
.
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,然后利用元素及其单质、化合物的性质来解答.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,
(1)以上元素中,只有Ne的最外层电子为8,为稳定结构,则化学性质不活泼,F的非金属性最强,则F2的氧化性最强,故答案为:Ne;F2;
(2)上述元素中,Na的金属性最强,则最高价氧化物的水化物NaOH的碱性最强,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,
二者反应的离子反应为Al(OH)3 +OH-═AlO2-+2H2O,
故答案为:NaOH;Al(OH)3;Al(OH)3 +OH-═AlO2-+2H2O;
(3)N、Cl、F中F的非金属性最强,则HF最稳定,故答案为:HF;
(4)NaCl为离子化合物,书写电子式时注意,左边写钠原子和氯原子电子式,右边写氯化钠的电子式,中间用箭头连接,用电子式表示氯化钠的形成过程为: ,
,
故答案为: .
.
点评 本题考查元素周期表和元素周期律,明确元素在周期表中的位置是解答本题的关键,然后利用单质、化合物的性质来解答即可,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
4.下列化学用语表示不正确的是( )
| A. | 钠离子的结构示意图: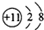 | |
| B. | 氢氧根离子的电子式: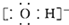 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
8.表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型).
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始产生白色沉淀,然后白色沉淀消失.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型).
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始产生白色沉淀,然后白色沉淀消失.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
18.小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)2•8H2O],并用玻璃棒搅拌,玻璃片上的水结成了冰.下列说法正确的是( )
| A. | 反应的热化学方程式为2NH4Cl+Ba(OH)2═BaCl2+2NH3•H2O;△H>0 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 氯化铵与氢氧化钡的反应为放热反应 | |
| D. | 该反应中,化学能全部转化为热能 |
2.一定温度下的密闭容器中存在如下反应:H2(g)+I2(g)?2HI(g);已知c始(H2)=0.4mol•L-1,c始(I2)=1mol•L-1,经测定该反应在该温度下的平衡常数K=64,当H2转化率为50%时,下列结论正确的是( )
| A. | 该反应达到平衡状态 | |
| B. | 该反应正在向左方向进行 | |
| C. | 达平衡状态时,H2的转化率应为96.3% | |
| D. | 增大H2的量,该反应平衡常数将减小 |
3.下列有关元素周期律的叙述正确的是( )
| A. | 随着原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 元素周期律的实质是元素化合价呈周期性变化 |
 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下: