题目内容
16.为测定硫酸亚铁铵晶体【(NH4)2Fe(SO4)2•xH2O】中铁的含量,某实验小组做了如下实验:步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、溶解、转移、洗涤并转移、定容、摇匀.
(2)用酸式(“酸式”或“碱式”)滴定管盛放KMnO4溶液.
(3)当滴入最后一滴KMnO4溶液,出现溶液由黄色变成紫红色,且半分钟内不褪色,即到达滴定终点.反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(4)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
分析 (1)配制溶液需要称量、溶解、转移、洗涤并转移、定容、摇匀等操作;
(2)KMnO4溶液应用酸式滴定管盛装;
(3)Fe2+与KMnO4发生氧化还原反应,滴定终点时,溶液由黄色变成紫红色,且半分钟内不褪色;
(4)计算体积的平均值,根据反应的离子方程式计算.
解答 解:(1)配制溶液需要称量、溶解、转移、洗涤并转移、定容、摇匀等操作,故答案为:溶解;定容;
(2)KMnO4溶液具有强氧化性,应用酸式滴定管盛装,故答案为:酸式;
(3)Fe2+与KMnO4发生氧化还原反应,反应的离子方程式为MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
滴定终点时,溶液由黄色变成紫红色,且半分钟内不褪色,
故答案为:溶液由黄色变成紫红色,且半分钟内不褪色;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(4)取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定,所用高锰酸钾溶液体积为$\frac{21.04-1.05+24.50-1.50+20.21-0.20}{3}$mL=21mL,
n(MnO4-)=0.021L×0.01mol/L=2.1×10-4mol,
则n(Fe2+)=5×2.1×10-4mol=1.05×10-3mol,
5.000g硫酸亚铁铵晶体含有n(Fe2+)=1.05×10-2mol,
n(Fe2+)=56g/mol×1.05×10-2mol=0.588g,
实验测得该晶体中铁的质量分数为$\frac{0.588g}{5.00g}$≈11.20%,
故答案为:11.20%.
点评 本题考查物质的含量测定,侧重于滴定操作的考查,题目难度不大,注意把握相关实验基本方法和注意事项.

练习册系列答案
相关题目
4.下列化学用语表示不正确的是( )
| A. | 钠离子的结构示意图: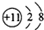 | |
| B. | 氢氧根离子的电子式: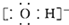 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
11. 请回答下列问题.
请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为c>a>b;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
 请回答下列问题.
请回答下列问题.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
8.表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型).
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始产生白色沉淀,然后白色沉淀消失.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型).
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始产生白色沉淀,然后白色沉淀消失.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
6.下列物质可用于治疗胃酸过多的是( )
| A. | 碳酸氢钠 | B. | 氢氧化铝 | C. | 氢氧化钠 | D. | 硫酸钡 |
