题目内容
14.下列关于中和滴定的操作错误的是( )| A. | 滴定前需要检查滴定管是否漏水 | |
| B. | 用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶 | |
| C. | 滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,会使滴定结果偏高 | |
| D. | 用已知浓度盐酸滴定未知浓度的NaOH溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低 |
分析 A、根据带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水;
B、根据盛装待测液的锥形瓶不能使用待测液润洗,否则待测液的物质的量偏大;
C、根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差;
D、根据滴定管的读数从上到下依次增大以及测量原理.
解答 解:A、滴定管是带有旋塞的仪器,使用前需要检查是否漏水,故A正确;
B、对应加入的溶液润洗的仪器有:酸式滴定管,锥形瓶度不能使用待测液润洗,否则待测液的物质的量偏大,引起误差,故B错误;
C、滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故C正确;
D、终点读数时俯视滴定管的刻度,读数值偏小,造成V(标准)偏小,故D正确;
故选B.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度不大.

练习册系列答案
相关题目
17.含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
则该反应的△H=+1268kJ/mol.
(2)电厂烟气脱氮的主要反应
I:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H<0,副反应
II:2NH3(g)+8NO(g)═5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为K=$\frac{{c}^{6}({H}_{2}O){c}^{5}({N}_{2})}{{c}^{6}(NO){c}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3) 和n(N2) 随时间变化的关系如图1所示:
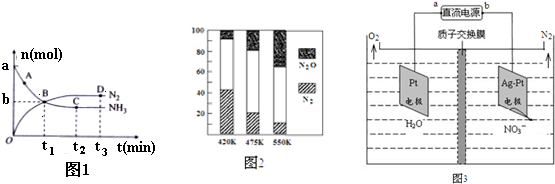
用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$ (用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=N2+6H2O.
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)电厂烟气脱氮的主要反应
I:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H<0,副反应
II:2NH3(g)+8NO(g)═5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为K=$\frac{{c}^{6}({H}_{2}O){c}^{5}({N}_{2})}{{c}^{6}(NO){c}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3) 和n(N2) 随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$ (用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=N2+6H2O.
2. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”或“偏低”或“无影响”);
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL;
(4)根据下列数据:
计算得出待测烧碱溶液的物质的量浓度为0.08000mol•L-1.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”或“偏低”或“无影响”);
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL;
(4)根据下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
9. 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
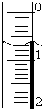
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
4.下列化学用语表示不正确的是( )
| A. | 钠离子的结构示意图: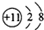 | |
| B. | 氢氧根离子的电子式: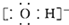 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
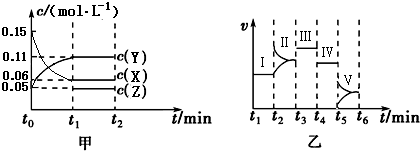
 2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.
2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.
 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下: