题目内容
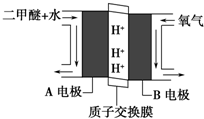
1.一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
| A. | b极为电池的负极 | |
| B. | 当1mol乙醇被氧化转移12NA个电子 | |
| C. | 电池工作时电流由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应为:O2+4e-+2H2O=4OH- |
分析 由质子的定向移动可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合电极反应解答该题.
解答 解:A.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,b是正极,故A错误;
B.根据电池反应:C2H5OH+3O2=2CO2+3H2O,乙醇被氧化电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则1mol乙醇被氧化失去12mol电子,即1mol乙醇被氧化转移12NA个电子,故B正确;
C.电池工作时,电子在电路中从负极流向正极,在该电池中,电子由a极流向b极,故C错误;
D.在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,故D错误;
故选B.
点评 本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法.

练习册系列答案
相关题目
11.将少量金属钠放入盛有CuSO4溶液的烧杯中,烧杯中发生的反应是( )
①2Na+CuSO4═Na2SO4+Cu
②Cu+2H2O═Cu(OH)2↓+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.
①2Na+CuSO4═Na2SO4+Cu
②Cu+2H2O═Cu(OH)2↓+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.
| A. | ① | B. | ①② | C. | ③④ | D. | ①③ |
16.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和水,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS 与HNO3的物质的量之比为( )
| A. | 1:6 | B. | 1:7 | C. | 2:11 | D. | 16:25 |
6.以下氧化物既可以与酸反应,又可以与碱反应的是( )
| A. | FeO | B. | Fe2O3 | C. | Al2O3 | D. | Fe3O4 |
10.下列关于金属的描述不正确的是( )
| A. | 金属单质都有还原性 | |
| B. | 镁、铝虽然还原性较强,但可以直接置于空气中保存,是因为表面能形成致密的氧化膜,保护了内层的金属 | |
| C. | 铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高 | |
| D. | 钠和镁可以剧烈地燃烧,铝和铁则不能燃烧 |
 (1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.
(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.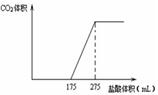 取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: