题目内容
11.在一定条件下可实现如图所示物质之间的变化:请填写以下空白:(1)孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解.写出其分解的化学方程式CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O↑.
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:Al3++4OH-═AlO2-+2H2O.
(3)写出过量F通入A中生成沉淀的离子方程式:AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-.
(4)每生成1mol D(固体),同时生成0.75 molE.
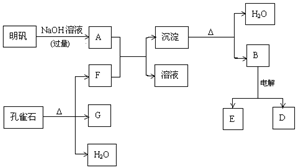
分析 明矾主要成分为KAl(SO4)2,能够电离出Al3+,与过量NaOH溶液反应生成偏铝酸钠,孔雀石受热分解生成氧化铜、二氧化碳和水,产物二氧化碳能够和偏铝酸钠反应生成沉淀氢氧化铝,氢氧化铝受热分解生成氧化铝,工业冶炼铝2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.所以A为NaAlO2,B为Al2O3,F为CO2,G和D都是固体,D为Al,G为CuO,以此解答该题.
解答 解:明矾主要成分为KAl(SO4)2,能够电离出Al3+,与过量NaOH溶液反应生成偏铝酸钠,孔雀石受热分解生成氧化铜、二氧化碳和水,产物二氧化碳能够和偏铝酸钠反应生成沉淀氢氧化铝,氢氧化铝受热分解生成氧化铝,工业冶炼铝2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.所以A为NaAlO2,B为Al2O3,F为CO2,G和D都是固体,D为Al,G为CuO,
(1)CuCO3•Cu(OH)2分解生成CuO、水和二氧化碳,方程式为CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2 CuO+CO2↑+H2O↑,故答案为:CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2 CuO+CO2↑+H2O↑;
(2)明矾与过量NaOH溶液反应生成偏铝酸钠和水,反应离子方程式为Al3++4OH-═AlO2-+2H2O,故答案为:Al3++4OH-═AlO2-+2H2O;
(3)F为CO2,A为NaAlO2,过量F通入A中生成沉淀的离子方程式为AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-;
(4)根据电解方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,每生成1mol Al,同时生成0.75molO2,故答案为:0.75.
点评 本题考查无机物的推断,为高频考点,把握明矾和过量氢氧化钠反应的产物能够与孔雀石分解的产物生成沉淀为推断的突破口,侧重Al及其化合物的性质及相互转化的考查,题目难度不大.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
| A. | b极为电池的负极 | |
| B. | 当1mol乙醇被氧化转移12NA个电子 | |
| C. | 电池工作时电流由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应为:O2+4e-+2H2O=4OH- |
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |

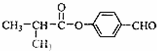 ;
;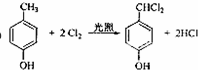 ;
;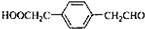 .
. 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.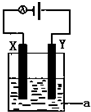 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1 ,B
,B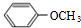 ,C
,C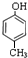 .
.