题目内容
17.硫酸铜在生产、生活中应用广泛.某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下: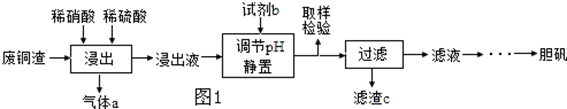
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O.
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是取试样少许放入试管中,滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净.
(3)滤渣c是Fe(OH)3.
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:2NO+O2═2NO2、3NO2+H2O=2HNO3+NO.
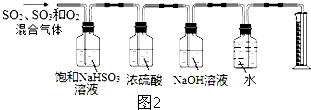
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式:3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑.某同学设计了如图2所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积.此设计有不合理之处,请说明理由:混合气体通过饱和碳酸氢钠溶液,三氧化硫被吸收生成硫酸,和碳酸氢钠反应生成二氧化硫,没法确定三氧化硫的质量,去掉盛饱和亚硫酸氢钠的装置即可.
分析 用含少量铁的废铜渣为原料生产胆矾,由制备流程可知,Fe与稀硝酸反应生成硝酸铁,Cu与硝酸、硫酸反应生成硫酸铜,同时生成c为NO,浸出液中含铁离子、铜离子,加试剂b为CuO或氢氧化铜等调节pH,促进铁离子水解转化为沉淀,过滤得到滤渣为Fe(OH)3,滤液含硫酸铜,蒸发浓缩、冷却结晶得到硫酸铜晶体,以此来解答.
解答 解:(1)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(2)用硫氰化钾检验铁离子的存在,铁离子遇硫氰化钾显红色,具体操作为:取试样少许放入试管中,滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净,故答案为:取试样少许放入试管中,滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净;
(3)由工艺流程图转化关系可知,浸出液中浆调节pH值后,铁离子转化为Fe(OH)3沉淀析出,滤渣c的主要成分为Fe(OH)3,故答案为:Fe(OH)3;
(4)二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(5)硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,反应物为CuSO4,生成物为CuO、SO2、SO3、O2,由原子、电子守恒可知反应为3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑;
图2所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积,SO3气体可溶解于浓硫酸中,采用98.3%的浓硫酸吸收SO3气体,SO2气体用碱液吸收,氧气用排水法测量,混合气体通过饱和亚硫酸氢钠溶液,三氧化硫被吸收生成硫酸,和碳酸氢钠反应生成二氧化硫,没法确定三氧化硫的质量,故应先让混合气体通过浓硫酸的装置,三氧化硫被吸收,增重即为三氧化硫的质量,再通过氢氧化钠溶液吸收二氧化硫,增重即为二氧化硫的质量,最后用排水法测量氧气的体积,
故答案为:3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑;混合气体通过饱和碳酸氢钠溶液,三氧化硫被吸收生成硫酸,和碳酸氢钠反应生成二氧化硫,没法确定三氧化硫的质量,去掉盛饱和亚硫酸氢钠的装置即可.
点评 本题考查物质的制备实验,为高频考点,把握制备流程、发生的反应、混合物分离为解答的关键,侧重分析与实验能力的考查,注意(5)为解答的难点,题目难度中等.

| A. | 石英 | B. | 氯化钠 | C. | 干冰 | D. | 钠 |
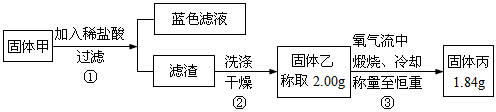
已知,氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,Cu在氧气流中锻烧,可以转化为氧化铜.硫化铜和硫化亚铜常温下都不溶于稀盐,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
下列用关说法正确的是( )
| A. | 加盐酸有蓝色溶液生成,说明固体甲中一定含有氧化铜 | |
| B. | 步骤①所得滤渣中肯定含有单质铜 | |
| C. | 固体甲中若存在Cu2O,也可能有Cu2S | |
| D. | 固体甲中,CuS和Cu2S不能同时存在 |
(1)N位于元素周期表第二 周期第ⅤA 族,其基态原子核外有3个未成对电子;S的基态原子核外电子排布式为1s22s22p63s23p4.
(2)用“>”或“<’’填空:
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)NH3可作低温溶剂,它易液化的原因是NH3分子间能形成分子间氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化.已知25℃、101KPa,NH3能在纯氧中燃烧,每转移1mol e-,放出akJ热量,写出该条件下NH3燃烧的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-4a kJ/mol.
(5)通常情况下,N2O5为无色晶体,它与Na2O2能发生反应(类似于CO2与Na2O2能反应),写出反应的化学方程式,并用单线桥标出电子转移的方向和数目:
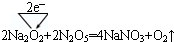 .
. | A. | 11H | B. | 12H | C. | -10e | D. | 01n |
| A. | CH3COOH | B. | HNO3 | C. | CH3CH2OH | D. | NaOH |
| A. | 2.24b L | B. | $\frac{c-a}{71}$×22.4L | C. | $\frac{c-a}{17}$×22.4L | D. | $\frac{a-c}{35.5}$×22.4L |
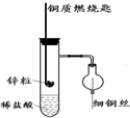 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.