题目内容
下列各组中化合物的性质比较,不正确的是( )
| A、稳定性:PH3>H2S>HCl |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、酸性:HClO4<HBrO4<HIO4 |
| D、非金属性:F>O>S |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:A、元素的非金属性越强,对应的氢化物的稳定性越强;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、同一周期元素,随着原子序数增大,其金属性逐渐减弱、非金属性逐渐增强;同一主族元素,其金属性随着原子序数增大而增强,非金属性随着原子序数增大而减弱.
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、同一周期元素,随着原子序数增大,其金属性逐渐减弱、非金属性逐渐增强;同一主族元素,其金属性随着原子序数增大而增强,非金属性随着原子序数增大而减弱.
解答:
解:A、元素的非金属性越强,对应的氢化物的稳定性越强,而非金属性P<S<Cl,所以氢化物的稳定性:PH3<H2S<HCl,故A错误;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg>Al,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>Br>I,所以酸性HClO4>HBrO4>HIO4,故C错误;
D、同一周期元素,随着原子序数增大,其金属性逐渐减弱、非金属性逐渐增强;同一主族元素,其金属性随着原子序数增大而增强,非金属性随着原子序数增大而减弱,所以非金属性:F>O>S,故D正确;
故选AC.
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg>Al,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>Br>I,所以酸性HClO4>HBrO4>HIO4,故C错误;
D、同一周期元素,随着原子序数增大,其金属性逐渐减弱、非金属性逐渐增强;同一主族元素,其金属性随着原子序数增大而增强,非金属性随着原子序数增大而减弱,所以非金属性:F>O>S,故D正确;
故选AC.
点评:本题综合考查元素周期律知识,侧重于学生的分析能力和综合运用化学知识的能力的考查,注意把握元素周期律的递变规律以及元素的金属性、非金属性与对应单质、化合物的关系,难度不大.

练习册系列答案
相关题目
氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和
O2+H2O+2e-═2OH-.则下列叙述正确的是( )
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、工作一段时间后电解质溶液pH增大 |
| D、此电池能发出淡蓝色火焰 |
下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ | ||||
B、C+H2O
| ||||
| C、Na2O+H2O═2NaOH | ||||
| D、2F2+2H2O═4HF+O2 |
当干冰熔化或气化时,下列各项中发生变化的是( )
| A、分子内化学键 | B、分子间距离 |
| C、分子构型 | D、氢键 |
国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左到右改为18列.如碱金属元素为第1列,稀有气体元素为第18列.按此规定,下列说法错误的是( )
| A、第9列元素中没有非金属元素 |
| B、只有第2列元素原子最外层有2个电子 |
| C、第1列(H除外)和第17列元素的单质熔沸点变化趋势相反 |
| D、在整个18列元素中,第3列的元素种类最多 |
下列化学用语书写正确的是( )
A、氯离子的结构示意图: | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: | ||
D、用电子式表示氯化氢分子的形成过程: + + → →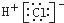 |
