题目内容
2. 电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A、C两点对应溶液均呈中性 | |
| C. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L |
分析 溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应式离子浓度最小,继续加入NaOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 mol/LNaOH溶液滴定CH3COOH溶液的滴定曲线,据此分析.
解答 解:A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,故A正确;
B.由分析可知,曲线①代表0.1 mol/LNaOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,所以A点对应溶液为醋酸钠,发生水解显碱性,C两点对应为氯化钠溶液呈中性,故B错误;
C.B点溶液中,滴入NaOH溶液为20ml,则溶液组成为等量的CH3COONa和NaOH,因为醋酸根水解,则c(Na+)>c(OH-)>c(CH3COO-),故C正确;
D.A点溶液中c(Na+)=$\frac{0.1×10}{20}$mol/L=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,故D正确;
故选B.
点评 本题以电导率为载体考查离子浓度大小比较、盐类水解等知识点,题目难度中等,明确混合溶液中溶质及其性质、溶液导电性强弱影响因素是解本题关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.下列关于该反应的说法正确的是( )
| A. | TiO2是氧化剂 | |
| B. | 四氯化钛是还原产物 | |
| C. | Cl2发生氧化反应 | |
| D. | 氧化剂与还原剂的物质的量之比为1:2 |
13.下列做法不能体现低碳生活的是( )
| A. | 注意节约用水 | B. | 减少食品加工过程 | ||
| C. | 发展氢能和太阳能 | D. | 大量使用化石燃料 |
17.利用如图所示装置可以将温室气体CO2转化为燃料气体CO.下列说法中,正确的是( )

| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | 电极a表面发生还原反应 | |
| C. | 该装置工作时,H+从b极区向a极区移动 | |
| D. | 该装置中每生成1 mol CO,同时生成1 mol O2 |
7.下列反应的发生与沉淀溶解平衡或盐类水解平衡的移动无关的是( )
| A. | 硝酸银溶液与盐酸反应生成氯化银 | |
| B. | 镁条与氯化铵溶液反应生成氢气 | |
| C. | 盐酸与碳酸钙反生成二氧化碳 | |
| D. | 硫酸铝溶液和小苏打溶液反应生成二氧化碳 |
14.下列关于金属铬的叙述中不正确的是( )
| A. | 铬元素在周期表中处于第四周期V IB族 | |
| B. | 铬原子的外围电子层排布为3d44s2 | |
| C. | 铬原子中,质子数为24 | |
| D. | 铬元素位于元素周期表的d区,是过渡元素 |
11.下面说法正确的是( )
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为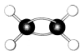 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
12.向含有FeCl3、BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤,向滤液中滴入KSCN溶液时无明显现象,由此得出的正确结论是( )
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO4 | ||
| C. | 白色沉淀是BaSO3、BaSO4的混合物 | D. | FeCl3全部被SO2氧化为FeCl2 |