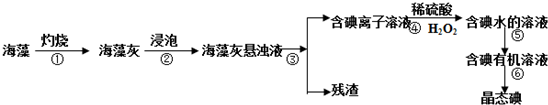
题目内容
3.钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.下列关于该反应的说法正确的是( )| A. | TiO2是氧化剂 | |
| B. | 四氯化钛是还原产物 | |
| C. | Cl2发生氧化反应 | |
| D. | 氧化剂与还原剂的物质的量之比为1:2 |
分析 TiO2+2C+2Cl2→TiCl4+2CO中,C元素的化合价升高,则C为还原剂,Cl元素的化合价降低,则Cl2为氧化剂,以此来解答.
解答 解:A.Ti、O元素的化合价不变,则TiO2不是氧化剂,故A错误;
B.TiO2+2C+2Cl2→TiCl4+2CO中,Cl元素的化合价降低,则Cl2为氧化剂,生成四氯化钛是还原产物,故B正确;
C.Cl元素的化合价降低,则Cl2为氧化剂,发生还原反应,故C错误;
D.氯气为氧化剂,C为还原剂,由反应可知,氧化剂与还原剂的物质的量之比为1:1,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | H2SO4的摩尔质量与NA个硫酸分子的质量在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 28 g氮气所含原子数目为NA | |
| D. | 在标准状况下,0.5 NA个氯气分子所占的体积为11.2 L |
14.下列对实验过程的评价正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- |
18.下列说法正确的是( )
| A. | 氯气通入水中,有化学键的断裂与形成 | |
| B. | MgCl2晶体中存在离子键与共价键 | |
| C. | NH3和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | CO2和SiO2晶体都是由分子构成的 |
8.下列反应的反应物中,第IVA族元素的氧化物作为氧化剂的是( )
| A. | Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ | B. | CO+H2O$\stackrel{高温}{?}$CO2+H2 | ||
| C. | CO2+2NaOH═Na2CO3+H2O | D. | CO+2H2$\stackrel{一定条件}{→}$CH3OH |
1.下列分子式表示的物质,不具有同分异构体的是( )
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C4H6 |
2. 电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
 电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A、C两点对应溶液均呈中性 | |
| C. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L |
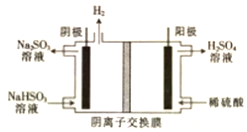 电解原理在工业生产中应用广泛.
电解原理在工业生产中应用广泛.