题目内容
17.已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,下列反应放热为57.3kJ的是( )| A. | 1mol稀H2SO4与足量NaOH溶液反应 | |
| B. | 稀醋酸与NaOH溶液反应生成1mol H2O | |
| C. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol H2O | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol H2O |
分析 中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量,据此解题.
解答 解:A.1mol稀H2SO4与足量NaOH溶液反应生成2mol水,故A错误;
B.醋酸是弱酸,电离过程需要吸热,稀醋酸与NaOH溶液反应生成1mol H2O放出的热量会小于57.3kJ,故B错误;
C.稀盐酸与稀Ba(OH)2溶液反应生成1mol水的实质是:H++OH-=H2O,放出的热量是57.3kJ,故C正确;
D.浓硫酸的溶解过程释放热量,所以稀NaOH与95%浓硫酸生成1mol水放出的热量大于57.3kJ,故D错误.
故选C.
点评 本题主要考查了中和热的理解及有关计算等,题目难度不大,注意中和热的含义,明确弱酸的电离过程吸热和浓硫酸稀释放热是解题的关键.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
7.下列各项比较错误的是( )
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
8.下列各组化合物的性质比较,不正确的是( )
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
5.可逆反应H2(g)+I2(g)═2HI(g)达到平衡时的标志是( )
| A. | 混合气体密度恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | H2、I2、HI在混合气体中体积分数相等 |
12.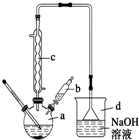 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)步骤1仪器a中发生的主要反应是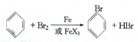 ;
;
(2)仪器c的名称是冷凝管,仪器d的作用是吸收HBr防污染,防倒吸;
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率;
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式);
(5)步骤4得到的粗产品中还含有杂质苯,已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
(6)实验结束后,试设计实验方案检验d装置所得溶液中含有Br-:
实验操作:取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液;
实验现象和结论:有淡黄色沉淀生成,溶液中含有Br-.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;(2)仪器c的名称是冷凝管,仪器d的作用是吸收HBr防污染,防倒吸;
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率;
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式);
(5)步骤4得到的粗产品中还含有杂质苯,已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
(6)实验结束后,试设计实验方案检验d装置所得溶液中含有Br-:
实验操作:取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液;
实验现象和结论:有淡黄色沉淀生成,溶液中含有Br-.
2.在下列各组离子中,能大量共存的( )
| A. | Ag+、NO3-、Na+、Cl- | B. | K+、HCO3-、Cl-、Al3+ | ||
| C. | NO3-、Fe2+、H+、Br- | D. | K+、Cl-、SO42-、NH4+ |
6.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 1molP4含有P-P键的个数为4NA | |
| B. | 1 mol Na2O2晶体中含有阴阳离子总数为4NA | |
| C. | 1mol金刚石中含有C-C键的个数为2NA | |
| D. | 1molSiO2中含Si-O键的个数为2NA |
7.分子式为C4H10O2的同分异构体中,只有一种官能团且能与钠反应的共有(已知:同一个碳上连有多个羟基不
稳定)( )
稳定)( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
 ;
;