题目内容
6.下列物质在水中的电离方程式书写正确的是( )| A. | NaOH═Na++O2-+H+ | B. | MgCl2═Mg2++Cl22- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NH4NO3═NH4++NO3- |
分析 A.NaOH是强电解质,在水溶液中完全电离生成钠离子和氢氧根离子;
B.氯化镁是强电解质,在水溶液中完全电离生成镁离子和2个氯离子;
C.氯酸钾是强电解质,在水溶液中完全电离生成钾离子和氯酸根离子,氯酸根离子是原子团不能拆开;
D.硝酸铵是强电解质,在水溶液中完全电离生成铵根离子和硝酸根离子.
解答 解:A.NaOH是强电解质,在水溶液中完全电离生成钠离子和氢氧根离子,电离方程式为NaOH═Na++OH-,故A错误;
B.氯化镁是强电解质,在水溶液中完全电离生成镁离子和2个氯离子,电离方程式为MgCl2═Mg2++2Cl2-,故B错误;
C.氯酸钾是强电解质,在水溶液中完全电离生成钾离子和氯酸根离子,氯酸根离子是原子团不能拆开,电离方程式为KClO3═K++ClO3-,故C错误;
D.硝酸铵是强电解质,在水溶液中完全电离生成铵根离子和硝酸根离子,电离方程式为NH4NO3═NH4++NO3-,故D正确;
故选D.
点评 本题考查电离方程式书写,电离方程式书写时原子团不能拆开,要注意电荷与化合价表示方法的区别,题目难度不大.

练习册系列答案
相关题目
17.某学生血液化验单中“葡萄糖”的结果为5.04×10-3mol•L-1.这里的“5.04×10-3 mol•L-1”表示葡萄糖的( )
| A. | 物质的量 | B. | 摩尔质量 | C. | 质量分数 | D. | 物质的量浓度 |
14.下列说法正确的是( )
| A. | 通式相同的不同物质一定属于同系物 | |
| B. | 完全燃烧某有机物,生成CO2和H2O的物质的量之比为1:1,该有机物只可能是烯烃或环烷烃 | |
| C. | 分子式相同而结构不同的化合物一定互为同分异构体 | |
| D. | 符合通式CnH2n-2的有机物一定是炔烃 |
1.海带中富含碘元素.从海带中提取碘有如下步骤:( )
①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
| A. | ①②③④⑤ | B. | ②⑤①③④ | C. | ①③⑤②④ | D. | ②①③⑤④ |
11.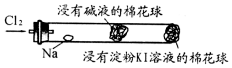 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
烧,并产生大量白烟.以下叙述错误的是( )
 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
| A. | 钠着火燃烧产生苍白色火焰和白烟 | |
| B. | 白烟是氯化钠微晶分散在空气中形成 | |
| C. | 玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境 | |
| D. | 根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收 |
1.以下是25℃时几种难溶电解质的溶解度:
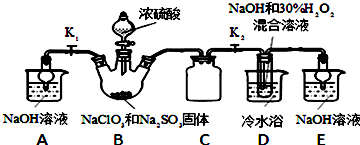
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE.
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE.
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
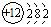 ,O2-结构示意图:
,O2-结构示意图: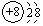 .
.
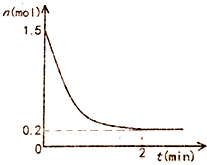 在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:
在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示: