题目内容
4. 在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.(1)按电子排布,Q元素在周期表中属ds区.
(2)第一电离能Y>Z,电负性Y<Z(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2,W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为sp3杂化,YW3分子的立体构型为三角锥形,YW3极易溶于W2Z的主要原因有都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O发生反应.
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有配位键、极性键.
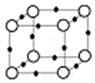
(5)Q+与Y3-形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏加德罗常数用NA 表示,则晶体的密度为$\frac{2.6×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3.
分析 已知W与其余五种元素既不同周期也不同主族,而且原子序数最小,所以W是氢元素,X原子的L层p轨道中有2个电子,所以X是碳元素,Y元素原子的最外层有3个自旋方向相同的未成对电子,所以Y元素是氮元素,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子原子序数比氮大,所以Z是氧元素,Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态,所以核外电子排布式为:1s22s22p63s23p63d104s1,由此分析解答.
解答 解:(1)核外电子排布式为:1s22s22p63s23p63d104s1,所以Q元素在周期表中属ds 区,故答案为:ds;
(2)氮核外电子排布处于半满状态,所以第一电离能Y>Z,同周期从左往右电负性增强,所以电负性Y<Z,故答案为:>;<;
(3)H2O分子中O原子的杂化类型为sp3杂化,NH3分子中N原子的杂化类型为sp3杂化,分子的立体构型为三角锥形,氨气与水分子间存在氢键,所以NH3极易溶于H2O,氨气与水反应生成一水合氨,故答案为:sp3杂化;三角锥形;都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O发生反应;
(4)硫酸铜溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,[Cu(NH3)4]2+中含有的化学键有配位键、极性键,故答案为:配位键、极性键(5)Cu+与N3-形成的晶胞结构如图所示,则晶胞边长为2acm,该晶胞中灰色球个数=8×$\frac{1}{8}$=1、黑色球个数=12×$\frac{1}{4}$=3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3-相连的Cu+有6个,该晶体的密度=$\frac{m}{V}$=$\frac{\frac{64×3+14}{{N}_{A}}}{(2a×1{0}^{-10})^{3}}$=$\frac{2.6×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3,故答案为:$\frac{2.6×1{0}^{30}}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、分子空间构型、元素周期律、原子核外电子排布等知识点,综合性较强,明确基本原理及基本计算是解本题关键,难点是晶胞计算,题目难度中等.

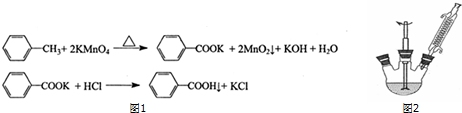
反应原理:
相关资料:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
①如图2组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/mL).
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)仪器 a名称为(蛇形)冷凝管.
(2)判断甲苯己完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52mL.V3=23.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为90%.
| A. | S2-离子的结构示意图: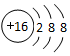 | B. | 硫酸铝的化学式:AlSO4 | ||
| C. | H2O2中O的化合价为-2价 | D. | 钾原子的原子结构示意图: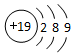 |
| A. | 通式相同的不同物质一定属于同系物 | |
| B. | 完全燃烧某有机物,生成CO2和H2O的物质的量之比为1:1,该有机物只可能是烯烃或环烷烃 | |
| C. | 分子式相同而结构不同的化合物一定互为同分异构体 | |
| D. | 符合通式CnH2n-2的有机物一定是炔烃 |
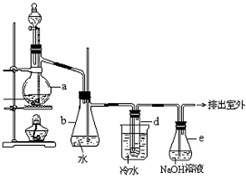 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;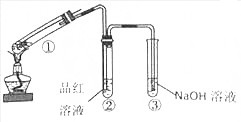
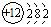 ,O2-结构示意图:
,O2-结构示意图: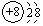 .
.