题目内容
X、Y、Z、W是元素周期表前四周期中的常见元素.其相关信息如表:
(1)W位于元素周期表第 周期第 族;Z的基态原子核外有 个原子轨道填充了电子.
(2)X的第一电离能比 Y 的 (填“大”或“小”); Y所在族各种元素的气态氢化物中沸点最低的是 (写化学式).
(3)X与Y形成原子个数比为1:2的两种化合物间存在化学平衡,请写出该反应的化学方程式及其平衡常数表达式 .
(4)X的原子与氢原子形成的一种分子中同时存在极性键、非极性键,写出该分子的电子式: .氢元素、X、Y 的原子可共同形成多种分子,写出其中一种分子和Z的简单离子反应的离子方程式: .
| 元素 | 相关信息 |
| X | X的基态原子价电子排布式为:nsnnpn+1 |
| Y | Y原子的最外层电子数是次外层的三倍 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(2)X的第一电离能比 Y 的
(3)X与Y形成原子个数比为1:2的两种化合物间存在化学平衡,请写出该反应的化学方程式及其平衡常数表达式
(4)X的原子与氢原子形成的一种分子中同时存在极性键、非极性键,写出该分子的电子式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四周期中的常见元素,X的基态原子价电子排布式为:nsnnpn+1,s能级上最多排2个电子,且p能级上还有电子,所以n为2,则x的基态原子最外层电子排布式为:2s22p3,所以X基态原子核外有7个电子,则X是N元素;
Y的基态原子Y原子的最外层电子数是次外层的三倍,所以y基态原子核外有8个电子,则Y是O元素;
Z存在质量数为27,中子数为14的核素,则其质子数是13,所以Z是Al元素;
W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体,则蓝色固体是氢氧化铜,所以W是Cu.
Y的基态原子Y原子的最外层电子数是次外层的三倍,所以y基态原子核外有8个电子,则Y是O元素;
Z存在质量数为27,中子数为14的核素,则其质子数是13,所以Z是Al元素;
W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体,则蓝色固体是氢氧化铜,所以W是Cu.
解答:
解:X、Y、Z、W是元素周期表前四周期中的常见元素,X的基态原子价电子排布式为:nsnnpn+1,s能级上最多排2个电子,且p能级上还有电子,所以n为2,则x的基态原子最外层电子排布式为:2s22p3,所以X基态原子核外有7个电子,则X是N元素;
Y的基态原子Y原子的最外层电子数是次外层的三倍,所以y基态原子核外有8个电子,则Y是O元素;
Z存在质量数为27,中子数为14的核素,则其质子数是13,所以Z是Al元素;
W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体,则蓝色固体是氢氧化铜,所以W是Cu.
(1)通过以上分析知,W是铜元素,铜元素位于第四周期第IB族,Z是Al元素,基态原子的核外电子排布式为1s22s22p63s23p1,又因为S只有一个轨道而p有三个轨道,故答案为:四;IB;7;
(2)X是N元素,Y是O元素,由于N元素2p轨道为半充满状态,较稳定,则N的第一电离能大于O,则有N>O;
Y所在族即O、S、Se、Te、Po各种元素的气态氢化物中,由于水分子间含氢键,故沸点最高,其余根据相对分子质量越大沸点越高,所以最低的为H2S
故答案为:大;H2S;
(3)X与Y形成原子个数比为1:2的两种化合物为NO2和N2O4存在化学平衡为2NO2?N2O4,再根据平衡常数的表达式得出K=
,
故答案:2NO2?N2O4,K=
;
(4)X的原子与氢原子形成的一种分子中同时存在极性键、非极性键,即N2H4,电子式为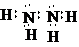 ,
,
氢元素、X、Y 的原子可共同形成多种分子,即H、N、O原子形成的分子要和Al3+反应,则H、N、O原子形成的分子要有碱性即氨水,所以反应的离子方程式为:
Al3++3NH3.H2O=Al(OH)3+3NH4+,故答案为: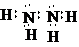 ;Al3++3NH3.H2O=Al(OH)3+3NH4+.
;Al3++3NH3.H2O=Al(OH)3+3NH4+.
Y的基态原子Y原子的最外层电子数是次外层的三倍,所以y基态原子核外有8个电子,则Y是O元素;
Z存在质量数为27,中子数为14的核素,则其质子数是13,所以Z是Al元素;
W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体,则蓝色固体是氢氧化铜,所以W是Cu.
(1)通过以上分析知,W是铜元素,铜元素位于第四周期第IB族,Z是Al元素,基态原子的核外电子排布式为1s22s22p63s23p1,又因为S只有一个轨道而p有三个轨道,故答案为:四;IB;7;
(2)X是N元素,Y是O元素,由于N元素2p轨道为半充满状态,较稳定,则N的第一电离能大于O,则有N>O;
Y所在族即O、S、Se、Te、Po各种元素的气态氢化物中,由于水分子间含氢键,故沸点最高,其余根据相对分子质量越大沸点越高,所以最低的为H2S
故答案为:大;H2S;
(3)X与Y形成原子个数比为1:2的两种化合物为NO2和N2O4存在化学平衡为2NO2?N2O4,再根据平衡常数的表达式得出K=
| C(N2O 4) |
| C 2(NO 2) |
故答案:2NO2?N2O4,K=
| C(N2O 4) |
| C 2(NO 2) |
(4)X的原子与氢原子形成的一种分子中同时存在极性键、非极性键,即N2H4,电子式为
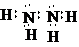 ,
,氢元素、X、Y 的原子可共同形成多种分子,即H、N、O原子形成的分子要和Al3+反应,则H、N、O原子形成的分子要有碱性即氨水,所以反应的离子方程式为:
Al3++3NH3.H2O=Al(OH)3+3NH4+,故答案为:
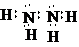 ;Al3++3NH3.H2O=Al(OH)3+3NH4+.
;Al3++3NH3.H2O=Al(OH)3+3NH4+.
点评:本题考查元素的推断,涉及元素位置的判断、氢化物沸点的判断、电子式的书写、化学平衡常数的书写、离子方程式的书写等知识点,难点是元素的推断,应抓住元素体现的性质来解答.

练习册系列答案
相关题目
下列物质中,含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、CaCl2溶液 |
| C、KCl晶体 |
| D、液态HCl |
 3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )
3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )| A、图中C表示生成物NH3(g)的总能量 |
| B、断裂3molH-H和1mol N≡N所吸收的总能量大于形成6mol N-H所释放的总能量 |
| C、逆反应的活化能E(逆)=E+△H |
| D、3 H2(g)+N2(g)?2NH3(g)△H<0 |
下列说法正确的是( )
| A、同周期元素随核电荷数的增加,第一电离能依次增大 |
| B、元素原子的最外层电子数等于元素的最高化合价 |
| C、同主族元素从上到下,单质的熔点逐渐降低 |
| D、第ⅦA元素从上到下,其氢化物的还原性逐渐增强 |
元素周期表前36号元素的基态原子中,含有3个未成对电子的有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
 现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.
现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.