题目内容
元素周期表前36号元素的基态原子中,含有3个未成对电子的有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:周期表前36号元素中,原子基态时具有3个未成对电子,当位于第二周期时,外围电排布为2s22p3,为N元素;当位于第三周期时,外围电排布为或3s23p3,为P元素;当位于第四周期时,外围电排布为4s24p3,3d74s2、3d34s2,分别为:As、Co、Sc元素.
解答:
解:周期表前36号元素中,原子基态时具有3个未成对电子,当位于第二周期时,外围电排布为2s22p3,为N元素;当位于第三周期时,外围电排布为或3s23p3,为P元素;当位于第四周期时,外围电排布为4s24p3,3d74s2、3d34s2,分别为:As、Co、Sc元素,共有5种元素,故选C.
点评:本题考查核外电子排布,比较基础,学生容易忽略过渡元素,关键是对核外电子排布规律的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
| A、原子总数 | B、密度 |
| C、质量 | D、质子总数 |
下列实验对应的离子方程式正确的是( )
| A、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++7H2O2═2Mn2++6O2↑+10H2O |
若将7N原子的电子排布图画成 ,它违背了( )
,它违背了( )
 ,它违背了( )
,它违背了( )| A、能量守恒原理 |
| B、泡利不相容原理 |
| C、洪特规则 |
| D、能量最低原理 |
某学生在实验室制取乙酸乙酯(反应温度80℃左右)和乙酸丁酯(反应温度115~125℃),现有两套实验装置图Ⅰ和图Ⅱ.下列说法错误的是( )
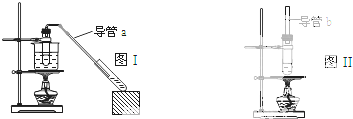

| A、制乙酸乙酯用图I装置,制乙酸丁酯用图II 装置 |
| B、导管a和导管b的作用都是冷凝回流 |
| C、都可用Na2CO3 溶液来洗去酯中的酸和醇 |
| D、加入过量的乙酸可以提高醇的转化率 |
 【物质结构域性质】
【物质结构域性质】 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3