题目内容
11.下列化学用语表示正确的是( )| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| C. | Na2O2的电子式: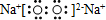 | |
| D. | 乙烯分子的结构简式:CH2CH2. |
分析 A.原子符号ZAX,左下角Z代表质子数,左上角A为质量数,X代表元素符号,其中质量数=质子数+中子数;
B.碳酸为弱酸,电离过程分步进行,电离方程式只写出第一步电离即可;
C.过氧化钠为离子化合物,阴阳离子需要标出所带电荷,阴离子还要标出最外层电子;
D.结构简式中应该标出官能团结构.
解答 解:A.含20个中子的氯原子,其质量数为17+20=37,故该核素的符号为1737Cl,故A错误;
B.H2CO3的电离分步进行,电离方程式只写出第一步即可,正确的电离方程式为:H2CO3?H++HCO3-,故B错误;
C.过氧化钠属于离子化合物,钠离子直接用离子符号表示,过氧根离子需要标出所带电荷及最外层电子,过氧化钠的电子式为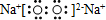 ,故C正确;
,故C正确;
D.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及结构简式、电子式、电离方程式、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
1.合金在现代生产、生活中应用非常广泛,因为它有许多优良的特性,下列关于合金性质的说法错误的是( )
| A. | 多数合金的硬度一般比其各成分金属的硬度高 | |
| B. | 多数合金的熔点一般比其各成分金属的熔点低 | |
| C. | 合金中可以含有非金属元素 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
19.下列离子方程式与所述事实相符且书写正确的是( )
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| D. | 已知苯甲酸的酸性比碳酸强,向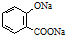 溶液中通入过量CO2: 溶液中通入过量CO2: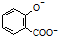 +2CO2+2H2O→ +2CO2+2H2O→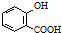 +2HCO3- +2HCO3- |
16.已知:H2O(g)═H2O(l)△H1=-Q1kJ•mol-1;C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ•mol-1;C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ•mol-1.若23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | Q1+Q2+Q3 | B. | 1.5Q1-0.5Q2+0.5Q3 | ||
| C. | 0.5Q1-0.5Q2+0.5Q3 | D. | 0.5(Q1+Q2+Q3) |
3.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3 mol FeS时,共转移6 mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
 (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.
 按要求回答下列问题:
按要求回答下列问题: ;
;