题目内容
下列有关说法正确的是( )
| A、在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 | ||||
B、0.1 mol?L-1氨水加水稀释后,溶液中
| ||||
| C、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||||
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
考点:弱电解质在水溶液中的电离平衡,反应热和焓变,金属的电化学腐蚀与防护
专题:
分析:A、金属作电极的原电池中,负极金属易被腐蚀,正极金属被保护;
B、加水时氨水的电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小;
C、醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,根据n=C×V比较二者的体积关系;
D、根据反应自发进行的判断依据△H-T△S<0分析解答.
B、加水时氨水的电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小;
C、醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,根据n=C×V比较二者的体积关系;
D、根据反应自发进行的判断依据△H-T△S<0分析解答.
解答:
解:A、锌、铁和海水构成原电池,锌作负极被腐蚀,铁作正极被保护,故A正确;
B、加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则比值增大,故B错误;
C、醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,所以:V1>V2,消耗盐酸的体积更大,故C错误;
D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△G=△H-T?△S<0,?△S<0,则该反应的△H<0,故D正确.
故选AD.
B、加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则比值增大,故B错误;
C、醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,所以:V1>V2,消耗盐酸的体积更大,故C错误;
D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△G=△H-T?△S<0,?△S<0,则该反应的△H<0,故D正确.
故选AD.
点评:本题考查了在铁件的表面镀铜、弱电解质的电离、反应自发进行的判断等知识点,注意C选项酸碱混合的定性判断,题目难度中等.

练习册系列答案
相关题目
在如图所示的两个电化学装置中,连接灵敏电流计的并接通电路,两个电流计的指针均明显 偏转,下列说法错误的是( )
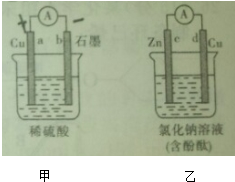

| A、甲溶液中H+的移动方向是a→b |
| B、b电极上的电极反应式为:2H++2e-═H2↑ |
| C、一段时间后,d电极附近的溶液变红 |
| D、乙装置中的溶液会逐渐变浑浊 |
下列关于氯水的叙述,正确的是( )
| A、新制氯水中只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸变红且不褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后pH将变小 |
14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,对上述反应下列各项判断正确的是( )
| A、反应中的氧化剂只有CuSO4 |
| B、7 mol CuSO4能氧化5mol-1价的硫 |
| C、被氧化的硫和被还原的硫个数之比是3:7 |
| D、FeS2既是氧化剂,又是还原剂 |
向0.1mol/LCH3COOH溶液中加人CH3COONa晶体或加等体积水稀释时.都会引起( )
| A、溶液的pH增大 |
| B、CH3COOH的电离程度增大 |
| C、溶液的导电能力减弱 |
| D、溶液的c(OH-)减小 |
下列各图所示的实验原理、方法、装置和操作不正确的是( )
A、 排空气法收集氨气 |
B、 量取5.3 mL稀盐酸 |
C、 检验K2CO3的K+ |
D、 转移溶液 |