题目内容
按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式)
(2)氯化铁溶液中通入二氧化硫气体(离子方程式)
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式)
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式) .
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式)
(2)氯化铁溶液中通入二氧化硫气体(离子方程式)
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式)
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式)
考点:化学方程式的书写,离子方程式的书写
专题:
分析:(1)氢氧化钠少量,参加反应的应该为碳酸氢根离子;
(2)三价铁具有氧化性,二氧化硫具有还原性,氯化铁与二氧化硫发生氧化还原反应生成硫酸根离子和二价铁离子;
(3)1mol氢氧化铝质量为78克,1mol硫酸钡沉淀为233克,所以硫酸铝钾与氢氧化钡溶液反应,生成沉淀质量最大时,生成硫酸钡沉淀,铝离子和碱反应生成偏铝酸根离子和水;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,据此解答;
(2)三价铁具有氧化性,二氧化硫具有还原性,氯化铁与二氧化硫发生氧化还原反应生成硫酸根离子和二价铁离子;
(3)1mol氢氧化铝质量为78克,1mol硫酸钡沉淀为233克,所以硫酸铝钾与氢氧化钡溶液反应,生成沉淀质量最大时,生成硫酸钡沉淀,铝离子和碱反应生成偏铝酸根离子和水;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,据此解答;
解答:
解:(1)氢氧化钠少量,碳酸氢根离子先参加反应生成了碳酸根离子,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)氯化铁具有氧化性,氧化二氧化硫为硫酸,发生的离子反应为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)1mol氢氧化铝质量为78克,1mol硫酸钡沉淀为233克,所以硫酸铝钾与氢氧化钡溶液反应,生成沉淀质量最大时,硫酸根离子全部转化生成硫酸钡沉淀,反应为:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O,
故答案为:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,碘化亚铁和氯气以5:7的物质的量比反应,设FeI2的物质的量为5xmol,则氧化I-需用Cl25x mol,剩余2xmolCl2氧,4xmolFe2+,所以反应为:5FeI2+7Cl2=4FeCl3+5I2+FeCl2,
故答案为:5FeI2+7Cl2=4FeCl3+5I2+FeCl2;
故答案为:HCO3-+OH-=CO32-+H2O;
(2)氯化铁具有氧化性,氧化二氧化硫为硫酸,发生的离子反应为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)1mol氢氧化铝质量为78克,1mol硫酸钡沉淀为233克,所以硫酸铝钾与氢氧化钡溶液反应,生成沉淀质量最大时,硫酸根离子全部转化生成硫酸钡沉淀,反应为:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O,
故答案为:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,碘化亚铁和氯气以5:7的物质的量比反应,设FeI2的物质的量为5xmol,则氧化I-需用Cl25x mol,剩余2xmolCl2氧,4xmolFe2+,所以反应为:5FeI2+7Cl2=4FeCl3+5I2+FeCl2,
故答案为:5FeI2+7Cl2=4FeCl3+5I2+FeCl2;
点评:本题考查了化学方程式和离子方程式的书写,题目难度中等,明确化学反应的实质是解题的关键,注意反应物的用量多化学反应的影响.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列氯化物中,不能用金属和盐酸反应得到的是( )
| A、FeCl3 |
| B、CuCl2 |
| C、NaCl |
| D、MgCl2 |
今有由铁的某种氧化物和铝粉组成的混合物X.为确定X中铁的氧化物的化学式 称取29.7gX隔绝空气高温下充分反应的混合物Y,Y与足量的氢氧化钠溶液反应收集到表准状况下气体3.36L,将反应液过滤、洗涤的固体Z将Z加入到120mL5mol?L-1 FeCl3溶液中,两者均恰好完全反应,则X中铁的氧化物为( )
| A、FeO |
| B、Fe3O4 |
| C、Fe2O3 |
| D、FeO2 |
下列有关说法正确的是( )
| A、在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 | ||||
B、0.1 mol?L-1氨水加水稀释后,溶液中
| ||||
| C、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||||
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
X、Y、Z、W四种元素在元素周期表中的相对位置如图所示,Y、Z的质子数之和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、常压下,W的常见单质有金刚石和石墨 |
| B、Z的阳离子与Y的阴离子电子层结构相同 |
| C、X的气态氢化物比Y的气态氢化物稳定 |
| D、W元素的金属性比Z元素的金属性强 |
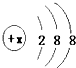 所示,该微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,这种微粒的符号是
所示,该微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,这种微粒的符号是 X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则: