题目内容
实验室所使用的NaOH标准溶液,通常是用准确称量的邻苯二甲酸氢钾(相对分子质量为204)来“标定”的.其操作步骤如下:
①将用分析天平称好的邻苯二甲酸氢钾置于锥形瓶中 ②加适量的蒸馏水溶解,溶液呈无色 ③加入指示剂 ④用NaOH溶液滴定到终点
某学生进行了三次平行实验,实验数据如下:
试回答下列问题
(1)邻苯二甲酸氢钾与NaOH溶液反应的离子方程式是 .
(2)所加指示剂最好选用 (填“甲基橙”“酚酞”或“石蕊”)判断达到终点的标志是 .
(3)该同学在进行滴定时,左手应该 ,右手应该 ,眼睛应该 .
(4)第 次实验误差较大,造成这种误差的可能原因是 .
A.碱式滴定管在装NaOH溶液前未用待测NaOH溶液润洗2-3次
B.滴定过程中,振荡太剧烈以致有些溶液飞溅出来
C.滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡
D.达到滴定终点时,俯视读数
(5)该同学所“标定”的NaOH溶液的物质的量浓度为 mol/L(结果保留三位数).
①将用分析天平称好的邻苯二甲酸氢钾置于锥形瓶中 ②加适量的蒸馏水溶解,溶液呈无色 ③加入指示剂 ④用NaOH溶液滴定到终点
某学生进行了三次平行实验,实验数据如下:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.612 | 21.20 |
| 2 | 0.612 | 20.10 |
| 3 | 0.612 | 19.90 |
(1)邻苯二甲酸氢钾与NaOH溶液反应的离子方程式是
(2)所加指示剂最好选用
(3)该同学在进行滴定时,左手应该
(4)第
A.碱式滴定管在装NaOH溶液前未用待测NaOH溶液润洗2-3次
B.滴定过程中,振荡太剧烈以致有些溶液飞溅出来
C.滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡
D.达到滴定终点时,俯视读数
(5)该同学所“标定”的NaOH溶液的物质的量浓度为
考点:中和滴定
专题:实验题
分析:(1)邻苯二甲酸氢钾与NaOH生成邻苯二甲酸钠钾和水;
(2)根据滴定终点的pH要在指示剂的变色范围之内确定指示剂;根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
(3)滴定时,左手控制滴定管活塞,右手握住锥形瓶,边滴边振荡,眼睛注视滴定管中的液面;
(4)根据表中数据分析,第1次操作与另外两次数据差别较大;根据c(酸)=
判断不当操作对相关物理量的影响;
(5)先邻苯二甲酸氢钾的质量求出物质的量,利用关系式求出氢氧化钠的物质的量,最后根据体积求出浓度.
(2)根据滴定终点的pH要在指示剂的变色范围之内确定指示剂;根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
(3)滴定时,左手控制滴定管活塞,右手握住锥形瓶,边滴边振荡,眼睛注视滴定管中的液面;
(4)根据表中数据分析,第1次操作与另外两次数据差别较大;根据c(酸)=
| c(碱)×V(碱) |
| V(酸) |
(5)先邻苯二甲酸氢钾的质量求出物质的量,利用关系式求出氢氧化钠的物质的量,最后根据体积求出浓度.
解答:
解:(1)邻苯二甲酸氢钾与NaOH生成邻苯二甲酸钠钾和水,其反应方程为: ;离子方程式为:HOOC-C6H4-COO-+OH-→-OOC-C6H4-COO-+H2O;
;离子方程式为:HOOC-C6H4-COO-+OH-→-OOC-C6H4-COO-+H2O;
故答案为:HOOC-C6H4-COO-+OH-→-OOC-C6H4-COO-+H2O;
(2)邻苯二甲酸氢钾为弱酸强碱盐,终点时溶液为碱性,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:酚酞;当滴加最后一滴NaOH溶液时,溶液由无色突变为粉红色,并半分钟内不褪色;
(3)该同学在进行滴定时,左手应该挤压碱式滴定管橡皮管玻璃球,右手应该振荡锥形瓶,眼睛应该注视溶液颜色的变化;
故答案为:挤压橡皮管玻璃球;振荡锥形瓶;注视溶液颜色的变化;
(4)对比表中数据,误差较大的是第1次实验,需要标准液的体积偏大,
A.碱式滴定管在装液前未用标准KOH溶液润洗2~3次,标准液浓度偏小,则标准液的体积偏大,故A正确;
B.滴定过程中,振荡太剧烈以致有些溶液飞溅出来,导致需要标准液体积偏小,故B错误;
C.滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡,则标准液的体积偏大,故C正确;
D.达到滴定终点时,俯视读数,会导致读数偏小,则标准液体积偏小,故D错误;
故答案:1;AC;
(5)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,n(邻苯二甲酸氢钾)=
=0.003mol,n(NaOH)=0.003mol,取2、3体积进行计算,所用标准液的平均体积为20.0mL,所以氢氧化钠溶液物质的量浓度为c(NaOH)=
=0.15mol/L;
故答案为:0.150;
 ;离子方程式为:HOOC-C6H4-COO-+OH-→-OOC-C6H4-COO-+H2O;
;离子方程式为:HOOC-C6H4-COO-+OH-→-OOC-C6H4-COO-+H2O;故答案为:HOOC-C6H4-COO-+OH-→-OOC-C6H4-COO-+H2O;
(2)邻苯二甲酸氢钾为弱酸强碱盐,终点时溶液为碱性,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:酚酞;当滴加最后一滴NaOH溶液时,溶液由无色突变为粉红色,并半分钟内不褪色;
(3)该同学在进行滴定时,左手应该挤压碱式滴定管橡皮管玻璃球,右手应该振荡锥形瓶,眼睛应该注视溶液颜色的变化;
故答案为:挤压橡皮管玻璃球;振荡锥形瓶;注视溶液颜色的变化;
(4)对比表中数据,误差较大的是第1次实验,需要标准液的体积偏大,
A.碱式滴定管在装液前未用标准KOH溶液润洗2~3次,标准液浓度偏小,则标准液的体积偏大,故A正确;
B.滴定过程中,振荡太剧烈以致有些溶液飞溅出来,导致需要标准液体积偏小,故B错误;
C.滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡,则标准液的体积偏大,故C正确;
D.达到滴定终点时,俯视读数,会导致读数偏小,则标准液体积偏小,故D错误;
故答案:1;AC;
(5)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,n(邻苯二甲酸氢钾)=
| 0.612g |
| 204g/mol |
| 0.003mol |
| 0.02L |
故答案为:0.150;
点评:本题考查中和滴定、指示剂的选择,浓度的计算等,难度中等,根据所学知识进行解答.

练习册系列答案
相关题目
保护地下钢管不受腐蚀,可使它连接( )
| A、铜板 | B、石墨 |
| C、直流电源负极 | D、直流电源正极 |
下列属于吸热反应的是( )
| A、中和反应 |
| B、金属与酸反应置换出H2 |
| C、燃烧反应 |
| D、炽热的炭与水蒸气反应制取水煤气 |


 +RCl→
+RCl→ +NaCl
+NaCl
 ).
).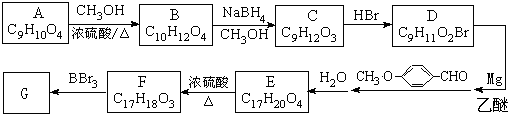
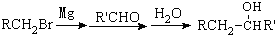
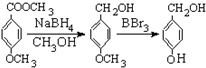
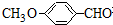 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题: