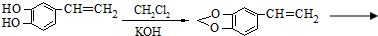题目内容
用两个石墨电极电解200mL的饱和食盐水(足量),当阴极析出2.24L氢气(标准状况),则:
(1)在阳极析出什么气体?
(2)该阳极气体标态下体积为多少升?
(3)若电解过程中,溶液体积不变,则电解质溶液的pH是多少?
(4)电解过程中,转移的电子数是多少?
(1)在阳极析出什么气体?
(2)该阳极气体标态下体积为多少升?
(3)若电解过程中,溶液体积不变,则电解质溶液的pH是多少?
(4)电解过程中,转移的电子数是多少?
考点:电解原理
专题:
分析:电解食盐水时,C1-在阳极失电子生成氯气,其电极反应式为:2C1--2e-=C12↑;阴极生成氢气,n(H2)=
=
=0.1mol;电解总反应2NaCl+2H2O
2NaOH+H2↑+Cl2↑,据此分析计算.
| V |
| Vm |
| 2.24 |
| 22.4 |
| ||
解答:
解:电解食盐水时,C1-在阳极失电子生成氯气,其电极反应式为:2C1--2e-=C12↑;阴极生成氢气,n(H2)=
=
=0.1mol;
(1)根据以上分析,在阳极析出C12;故答案为:C12;
(2)根据电解总反应2NaCl+2H2O
2NaOH+H2↑+Cl2↑,则阳极气体标态下体积与阴极氢气相同也为2.24L,答:阳极气体标态下体积为2.24L;
(3)已知2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当产生的H2的体积为2.24L即0.1mol时,生成氢氧化钠的物质的量为0.2mol,所以溶液中NaOH的物质的量浓度=
═1mol/L,所以氢离子的浓度为1×10-14mol/L,pH=14,答:电解质溶液的pH是14;
(4)根据以上分析,生成0.1mol H2,转移电子数 Ne═0.2NA,答:电解过程中,转移的电子数是0.2NA.
| V |
| Vm |
| 2.24 |
| 22.4 |
(1)根据以上分析,在阳极析出C12;故答案为:C12;
(2)根据电解总反应2NaCl+2H2O
| ||
(3)已知2NaCl+2H2O
| ||
| 0.2 |
| 0.2 |
(4)根据以上分析,生成0.1mol H2,转移电子数 Ne═0.2NA,答:电解过程中,转移的电子数是0.2NA.
点评:本题考查电解饱和食盐水,涉及电极产物的判断、化学方程式的计算等,难度不大,注意掌握化学方程式的计算是解题的关键.

练习册系列答案
相关题目
下列除杂方法不正确的是( )
| A、除去乙酸乙酯中混有的少量乙酸:加入饱和碳酸钠溶液,振荡、静置、分液 |
| B、除去乙醇中混有的少量水:加入适量的金属钠,充分反应后蒸馏 |
| C、除去溴苯中混有的少量溴:加入足量的氢氧化钠溶液,振荡、静置、分液 |
| D、除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 |
下列现象或事实可用同一原理解释的是( )
| A、氯化钠和氯化镁溶液分别与硝酸银溶液混合都能产生白色沉淀 |
| B、浓硫酸和稀盐酸长期暴露在空气中浓度降低 |
| C、氯水和活性炭使红墨水褪色 |
| D、漂白粉和水玻璃长期暴露在空气中变质 |
下列反应属于吸热反应的是( )
| A、2Mg十O2=2MgO |
| B、C十H2O=CO十H2 |
| C、HCl十NaOH=NaCl十H2O |
| D、CaO十H2O=Ca(OH)2 |

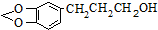 是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及 (无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.
(无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.