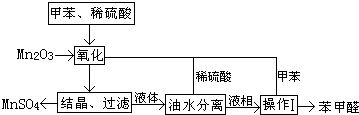
题目内容
下列说法错误的是( )
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:
分析:A、水溶液的导电能力与溶液中的离子浓度有关,与电解质的强弱无关;
B、HCl、H2SO4等都是强电解质,是共价化合物,Cu(OH)2是弱电解质,是离子化合物;
C、共价化合物形成的强电解质(如盐酸)液态不导电;
D、二氧化硫溶于水生成亚硫酸,亚硫酸导电.
B、HCl、H2SO4等都是强电解质,是共价化合物,Cu(OH)2是弱电解质,是离子化合物;
C、共价化合物形成的强电解质(如盐酸)液态不导电;
D、二氧化硫溶于水生成亚硫酸,亚硫酸导电.
解答:
解A、导电能力与溶液中的离子浓度有关,离子浓度大,导电能力强,与电解质的强弱无关,如硫酸钡属于强电解质,但在水溶液中很难溶解,其溶液导电能力弱,而乙酸是弱电解质,当离子浓度较大时,其水溶液导电能力强,故A正确;
B、HCl、H2SO4等都是强电解质,是共价化合物,Cu(OH)2是弱电解质,是离子化合物,故B错误;
C、共价化合物形成的强电解质(如硫酸)液态不导电,故C正确;
D、二氧化硫溶于水生成亚硫酸,亚硫酸导电,故D正确,故选B.
B、HCl、H2SO4等都是强电解质,是共价化合物,Cu(OH)2是弱电解质,是离子化合物,故B错误;
C、共价化合物形成的强电解质(如硫酸)液态不导电,故C正确;
D、二氧化硫溶于水生成亚硫酸,亚硫酸导电,故D正确,故选B.
点评:本题主要考查的是强电解质与弱电解质的概念以及导电能力与电解质的关系,属于常考题.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=-QkJ/mol达到平衡.缩小容器体积,重新达到平衡时C的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A、产物B的状态一定为气态 |
| B、平衡时,单位时间内消耗n(A)与消耗n(C)相等 |
| C、保持体积不变,向平衡体系中加入B平衡向逆反应方向移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ |
由二氧化硅制高纯硅的流程图如图,下列判断中错误的是( )
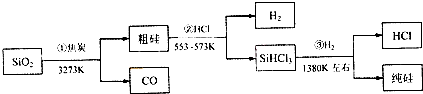

| A、①②③均属于氧化还原反应 |
| B、H2和HCl均可循环利用 |
| C、SiO2是一种坚硬难熔的固体 |
| D、光纤的主要成分是高纯度的单质硅 |
X、Y和Z三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为相同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y的最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7,下列叙述中不正确的是( )
| A、X和Y两种元素构成一种阴离子,该阴离子与强酸反应时,可能变成Y的阳离子 |
| B、元素Y的最高价氧化物能溶于Z的最高价氧化物的水化物中 |
| C、X、Y和Z三元素组成的化合物为碱 |
| D、X与Z的单质在不同条件下能生成不同的化合物 |