题目内容
A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B可以组成最简单的有机物,B与C可以组成两种中学化学中常见的气体;
③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为 元素,B为 元素,C为 元素,D为 元素,E为 元素(填元素名称).
(2)C元素在周期表中属 周期 族元素,原子结构简图为 .
(3)用电子式表示D与E形成化合物的过程 ,D与B形成的化合物的电子式 .
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B可以组成最简单的有机物,B与C可以组成两种中学化学中常见的气体;
③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为
(2)C元素在周期表中属
(3)用电子式表示D与E形成化合物的过程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,除A外,各元素原子的内层均已填满电子,即A内层未填满,则A为氢元素,在第一周期,则其它元素都在短周期,A、E在周期表中处于同一纵行,则E为钠元素,其中B的最外层有4个电子,则B为第ⅣA族元素,原子序数小于E,则B为碳元素,B与C可以组成两种中学化学中常见的气体,则C为氧元素,D与E生成离子化合物,其离子的电子层结构相同,则D为氟元素,据此答题;
解答:
解:A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,除A外,各元素原子的内层均已填满电子,即A内层未填满,则A为氢元素,在第一周期,则其它元素都在短周期,A、E在周期表中处于同一纵行,则E为钠元素,其中B的最外层有4个电子,则B为第ⅣA族元素,原子序数小于E,则B为碳元素,B与C可以(1)根据上面的分析可知,A为氢元素,B为碳元素,C为氧元素,D为氟元素,E为钠元素,
故答案为:氢;碳;氧;氟;钠;
(2)C为氧元素,在周期表中属周二期ⅥA族元素,原子结构简图为 ,
,
故答案为:二;ⅥA; ;
;
(3)D与E形成化合物为NaF,用电子式表示它的形成过程为 ,D与B形成的化合物为CF4,它的电子式为
,D与B形成的化合物为CF4,它的电子式为  ,
,
故答案为: ;
; ;
;
故答案为:氢;碳;氧;氟;钠;
(2)C为氧元素,在周期表中属周二期ⅥA族元素,原子结构简图为
 ,
,故答案为:二;ⅥA;
 ;
; (3)D与E形成化合物为NaF,用电子式表示它的形成过程为
 ,D与B形成的化合物为CF4,它的电子式为
,D与B形成的化合物为CF4,它的电子式为  ,
,故答案为:
 ;
; ;
;
点评:本题主要考查了原子结构示意图、电子式等知识点,难度不大,解题的关键在于元素的推断.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
某氧化物的化学式为R2O3,电子总数为50,已知氧原子核内有8个中子,R2O3的相对分子质量为102,则R原子核内中子数为( )
| A、10 | B、12 | C、14 | D、21 |
下列叙述正确的是( )
| A、一定温度、压强下,固体的体积只由其分子的大小决定 |
| B、一定温度、压强下,气体体积由其物质的量的多少决定 |
| C、等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度相等 |
| D、气体摩尔体积是指1mol任何气体所占的体积为22.4L |
一定有化学变化发生的过程是( )
| A、蒸馏 | B、升华 | C、燃烧 | D、蒸发 |
下列说法错误的是( )
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
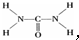 ,
,