题目内容
四种短周期元素的性质或结构信息如表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式 ;离子半径比较:Y离子 Z离子(填“>”或“<”).
(2)写出Z原子的核外电子排布式 .
(3)Z的最高价氧化物对应水化物的电离方程式 .
(4)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
(2)写出Z原子的核外电子排布式
(3)Z的最高价氧化物对应水化物的电离方程式
(4)元素T与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:T是人体内含量最多的元素,且其单质是常见的助燃剂,所以T是氧元素,X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼,所以X是氮元素,Y单质质软、银白色固体、导电性强,单质在空气中燃烧发出黄色的火焰,则Y是钠元素,Z是第三周期元素的简单离子中半径最小,所以Z是铝元素,据此答题;
解答:
解:T是人体内含量最多的元素,且其单质是常见的助燃剂,所以T是氧元素,X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼,所以X是氮元素,Y单质质软、银白色固体、导电性强,单质在空气中燃烧发出黄色的火焰,则Y是钠元素,Z是第三周期元素的简单离子中半径最小,所以Z是铝元素,
(1)T是氧元素,它的离子结构示意图为 ,X是氮元素,它的气态氢化物的电子式为
,X是氮元素,它的气态氢化物的电子式为 ,电子层结构相同时,核电荷数越多,离子半径越小,所以半径:Na+>Al3+,故答案为:
,电子层结构相同时,核电荷数越多,离子半径越小,所以半径:Na+>Al3+,故答案为: ;
; ;>;
;>;
(2)Z为铝元素,原子序数是13,所以它的原子的核外电子排布式为1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(3)氢氧化铝显两性,所以它的电离方程式为Al3++3OH-?Al(OH)3?AlO2-+H++H2O,故答案为:Al3++3OH-?Al(OH)3?AlO2-+H++H2O;
(4)T为氧元素,与氟元素相比,非金属性较强的是氟元素,可以证明这一事实的是,
a.根据常温下氟气的颜色比氧单质的颜色深,不能证明非金属性强弱;
b.氟气与T的氢化物剧烈反应,发生置换反应,产生氧的单质,就能证明非金属性氟比氧强;
c.氟与T形成的化合物中氧元素呈正价态,可以证明氟的非金属性比氧强;
d.电子的数目与得电子能力没有直接关系,所以比较两元素的单质与氢气化合时得电子数目不能证明非金属性氟比氧强;
故答案为:F;bc.
(1)T是氧元素,它的离子结构示意图为
 ,X是氮元素,它的气态氢化物的电子式为
,X是氮元素,它的气态氢化物的电子式为 ,电子层结构相同时,核电荷数越多,离子半径越小,所以半径:Na+>Al3+,故答案为:
,电子层结构相同时,核电荷数越多,离子半径越小,所以半径:Na+>Al3+,故答案为: ;
; ;>;
;>;(2)Z为铝元素,原子序数是13,所以它的原子的核外电子排布式为1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(3)氢氧化铝显两性,所以它的电离方程式为Al3++3OH-?Al(OH)3?AlO2-+H++H2O,故答案为:Al3++3OH-?Al(OH)3?AlO2-+H++H2O;
(4)T为氧元素,与氟元素相比,非金属性较强的是氟元素,可以证明这一事实的是,
a.根据常温下氟气的颜色比氧单质的颜色深,不能证明非金属性强弱;
b.氟气与T的氢化物剧烈反应,发生置换反应,产生氧的单质,就能证明非金属性氟比氧强;
c.氟与T形成的化合物中氧元素呈正价态,可以证明氟的非金属性比氧强;
d.电子的数目与得电子能力没有直接关系,所以比较两元素的单质与氢气化合时得电子数目不能证明非金属性氟比氧强;
故答案为:F;bc.
点评:本题主要考查了常用的化学用语及元素周期律等知识,难度不大,解题时注意根据元素的性质判断元素种类.

练习册系列答案
相关题目
短周期相邻的三种元素,它们的最外层电子数之和为16,电子层数之和为7.不属于这三种元素的是( )
| A、S | B、O | C、N | D、P |
下列说法错误的是( )
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
下列反应中,观察不到颜色变化的是( )
| A、往氨水中滴加酚酞 |
| B、往稀硫酸中通入氨气 |
| C、往品红溶液中通人足量二氧化硫气体 |
| D、氯气通入淀粉碘化钾溶液中 |
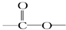 链状结构的同分异构体最多有
链状结构的同分异构体最多有