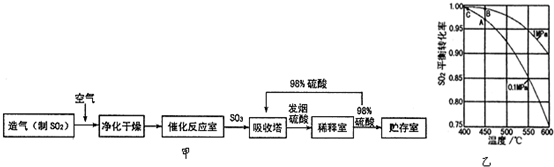
题目内容
某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=-QkJ/mol达到平衡.缩小容器体积,重新达到平衡时C的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A、产物B的状态一定为气态 |
| B、平衡时,单位时间内消耗n(A)与消耗n(C)相等 |
| C、保持体积不变,向平衡体系中加入B平衡向逆反应方向移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ |
考点:化学平衡的影响因素
专题:
分析:A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
B、单位时间内n(A)消耗=n(C)消耗说明正反应速率和逆反应速率相等,当正逆反应速率相等时,反应达到平衡状态;
C、不知道B的状态,若B为固态或液态时,加入B对平衡无影响;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q.
B、单位时间内n(A)消耗=n(C)消耗说明正反应速率和逆反应速率相等,当正逆反应速率相等时,反应达到平衡状态;
C、不知道B的状态,若B为固态或液态时,加入B对平衡无影响;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q.
解答:
解:达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等;
A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,故A错误;
B、单位时间内消耗n(A)与消耗n(C)相等,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、B可能不是气体,加B不一定发生平衡移动,故C错误;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故D错误;
故选B.
A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,故A错误;
B、单位时间内消耗n(A)与消耗n(C)相等,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、B可能不是气体,加B不一定发生平衡移动,故C错误;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故D错误;
故选B.
点评:本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解设计解题关键,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、一定温度、压强下,固体的体积只由其分子的大小决定 |
| B、一定温度、压强下,气体体积由其物质的量的多少决定 |
| C、等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度相等 |
| D、气体摩尔体积是指1mol任何气体所占的体积为22.4L |
海藻中含有丰富的碘元素.如图是实验室从海藻里提取碘的流程的一部分.下列判断正确的是( )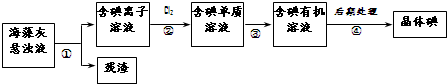

| A、步骤④的操作是过滤 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤①、③的操作分别是过滤、萃取 |
| D、步骤③中加入的有机溶剂可能是酒精或CCl4 |
下列说法错误的是( )
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
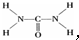 ,
,