题目内容
10.下列各组物质中(1)互为同分异构体的是⑤⑦,(2)互为同素异形体的是④,(3)互为同位素的是③,(4)属于同一物质的是②⑥.①C(CH3)4和C4H10②
 和
和
③35Cl和37Cl ④石墨和金刚石⑤(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH
⑥
 和
和 ⑦CH2=CH-CH2CH3和 CH3-CH=CH-CH3.
⑦CH2=CH-CH2CH3和 CH3-CH=CH-CH3.
分析 (1)同分异构体是指分子式相同,结构不同的有机物;
(2)同素异形体是指同种元素组成的不同单质;
(3)同位素是指质子数相同,中子数不同的同种元素的不同原子;
(4)同种物质是指分子式和结构式完全相同的物质;
解答 解:(1)同分异构体:分子式相同结构不同的化合物,⑤(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3分子式相同结构不同属于同分异构体,⑦CH2=CH-CH2CH3和 CH3-CH=CH-CH3.分子式相同结构不同属于同分异构体,
故答案为:⑤⑦;
(2)同素异形体:同种元素组成的不同单质,则④石墨和金刚石是碳元素的不同单质属于同素异形体,故答案为:④;
(3)同位素:质子数相同中子数不同的同一元素的原子互称同位素,则③35Cl和37Cl 互为同位素,故答案为:③;
(4)甲烷中四个氢原子是等效的,所以任意两个被Cl代替的结构只有一种,即属于同一种物质的是② 和
和 ,
,
⑥ 和
和 中物质均为3-甲基戊烷,是同一种物质,
中物质均为3-甲基戊烷,是同一种物质,
故答案为:②;⑥;
点评 本题考查了几种常见的化学用语,难度不大,解答时注意从其概念的内涵与外延出发,缜密思考,正确解答.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
2.如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素的单质中熔点最高的可能是碳(填名称).
(2)比较D、G氢化物的稳定性CH4>SiH4(用化学式表示).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为: ;
;
(4)D、E、G、H四种元素最高价含氧酸的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3>H2SiO3(填化学式).
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;Y是一种比水轻的油状液体,两种元素的质量比为12:1,Y的相对分子质量为78.
①X的结构简式CH2=CH2.
②Y与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式: +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,反应类型取代反应.
+H2O,反应类型取代反应.
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)比较D、G氢化物的稳定性CH4>SiH4(用化学式表示).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为:
 ;
;(4)D、E、G、H四种元素最高价含氧酸的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3>H2SiO3(填化学式).
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;Y是一种比水轻的油状液体,两种元素的质量比为12:1,Y的相对分子质量为78.
①X的结构简式CH2=CH2.
②Y与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式:
 +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,反应类型取代反应.
+H2O,反应类型取代反应.
1.下列离子方程式正确的是( )
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 明矾溶液与足量的氢氧化钡溶液混合:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
18.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硝酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 无水 乙醇 | 溴水 | 有乙烯生成 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 稀硫酸 | Na2CO3 | Na2SiO3 溶液 | 酸性: 稀硫酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
5.能正确表示下列反应的离子方程式是( )
| A. | 铝放入烧碱溶液中溶解:2Al+2OH-+2 H2O═2 AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 稀硫酸中加氢氧化钡溶液至中性:H++OH-═H2O | |
| D. | NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
15.美日三位科学家曾因对“有机物合成过程中钯催化交叉偶联”的研究获诺贝尔化学奖.评审委员会认定这项研究成果可以大大提升合成复杂化学物质的可能性.钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O═CO2+Pd↓+2HC1.对该反应的下列说法正确的是( )
| A. | CO作氧化剂,具有氧化性 | |
| B. | HCl是还原产物 | |
| C. | 反应中H2O提供了氧原子,因此H2O是氧化剂 | |
| D. | 生成22.4 L CO2(标准状况)时,转移的电子数为2NA |
2.在锌与盐酸反应的实验中,甲同学得到的结果如表所示:
按要求回答下列问题:
(1)温度对该反应速率的影响规律为温度越高,反应速率越快.
(2)对比结果B与F,F速率明显快的原因是粉末状的锌粉与酸接触面积大,反应速率快.
(3)乙同学将表面积相同、纯度相同、体积也相同的同种锌片分别投入等体积、浓度不同的稀硫酸和稀盐酸中(两酸中的氢离子浓度相同),仔细观察后发现,投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸的快,产生这一现象可能的原因是:硫酸根离子可能是这一反应的负催化剂或氯离子可能是正催化剂.(只需回答一条即可)如何用实验来验证向锌和稀硫酸反应中加氯化锌若反应速率加快则证明氯离子是正催化剂,或向锌和稀盐酸反应中加硫酸锌溶液在反应中若反应速率减慢则说明硫酸根离子是负催化剂.
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸所需的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(1)温度对该反应速率的影响规律为温度越高,反应速率越快.
(2)对比结果B与F,F速率明显快的原因是粉末状的锌粉与酸接触面积大,反应速率快.
(3)乙同学将表面积相同、纯度相同、体积也相同的同种锌片分别投入等体积、浓度不同的稀硫酸和稀盐酸中(两酸中的氢离子浓度相同),仔细观察后发现,投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸的快,产生这一现象可能的原因是:硫酸根离子可能是这一反应的负催化剂或氯离子可能是正催化剂.(只需回答一条即可)如何用实验来验证向锌和稀硫酸反应中加氯化锌若反应速率加快则证明氯离子是正催化剂,或向锌和稀盐酸反应中加硫酸锌溶液在反应中若反应速率减慢则说明硫酸根离子是负催化剂.
20.分子式为CnH2nO2的羧酸和某醇酯化生成分子式为Cn+2H2n+4O2的酯,反应所需羧酸和醇的质量比为1:1,则羧酸是( )
| A. | 甲酸 | B. | 乙酸 | C. | 丙酸 | D. | 乙二酸 |
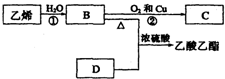 已知乙烯能发生以下转化:
已知乙烯能发生以下转化: