题目内容
19.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气.有关此电池的推断正确的是( )| A. | 放电过程中KOH的物质的量浓度不变 | |
| B. | 负极反应为14H2O+7O2+28e-=28OH- | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
分析 该燃料电池中,乙烷失电子发生氧化反应,应为原电池负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,据此分析解答该题.
解答 解:该燃料电池中,乙烷失电子发生氧化反应,应为原电池负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O.
A.该电池总反应为2C2H6+7O2+8KOH═4K2CO3+10H2O,有水生成,导致溶液体积增大,KOH参加反应导致物质的量减少,所以KOH浓度降低,故A错误;
B.负极发生氧化反应,应为C2H6+18OH--14e-=2CO32-+12H2O,故B错误;
C.电池工作过程中,负极反应为C2H6+18OH--14e-=2CO32-+12H2O,反应消耗OH-离子,溶液的pH值逐渐减小,故C错误;
D.负极电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,由电极方程式可知每消耗1molC2H6,则电路上转移的电子为14mol,故D正确;
故选D.
点评 本题考查原电池知识,题目难度中等,注意电极反应式的书写和电解质溶液的酸碱性变化,正确书写电极方程式为解答该题的关键.

练习册系列答案
相关题目
9.下列叙述正确的是( )
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
7.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.图为N2(g)和O2(g)生成NO(g)过程中的能量变化,下列说法中正确的是( )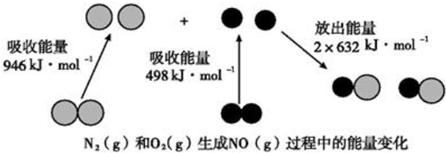

| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |
14.海水是巨大的资源宝库,海水中主要离子的含量如表所示.
从海水中提取食盐和溴的工艺流程如图:
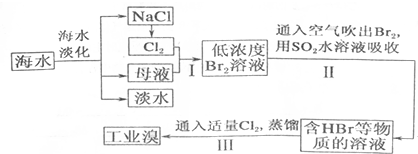
(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
4.将500mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol NaOH的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全,则该化合物溶液中c(Na+)为( )
| A. | ($\frac{b}{10}$-$\frac{a}{20}$) mol•L-1 | B. | (2b-a) mol•L-1 | C. | (5b-$\frac{5a}{2}$) mol•L-1 | D. | (10b-5a) mol•L-1 |
11.世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;
②在海水中加入生石灰,过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤;
④在氯化氢热气流中加热晶体;
⑤电解上述所得盐(熔融条件下).
下列说法正确的是( )
①把贝壳制成生石灰;
②在海水中加入生石灰,过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤;
④在氯化氢热气流中加热晶体;
⑤电解上述所得盐(熔融条件下).
下列说法正确的是( )
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验. 与
与 B.
B. 与
与 C.
C. 与
与 D.
D. 与
与 E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F. 与CH3-CH2Cl.
与CH3-CH2Cl.