题目内容
5.下列说法中,正确的是( )| A. | ${\;}_{83}^{209}$Bi 和${\;}_{83}^{210}$Bi都含有83个中子 | |
| B. | 同位素:H2、D2、T2 | |
| C. | H2O和NH3分子中具有相同的质子数和电子数 | |
| D. | 稀有气体的原子最外层都达到8电子稳定结构,故都不能与别的物质发生反应 |
分析 A.元素符号的左下角为质子数,不是中子数;
B.同位素的研究对象为原子;
C.水分子和氨气分子中都含有10个质子和10个电子;
D.稀有气体化学性质稳定,但是稀有气体也能够发生反应.
解答 解:A.二者为Bi的同位素,83为质子数,不是中子数,故A错误;
B.H2、D2、T2都素氢气分子,H、D、T之间互为同位素,故B错误;
C.H2O和NH3分子中质子数、电子数都是10,二者具有相同的质子数和原子数,故C正确;
D.稀有气体的原子最外层都达到8电子稳定结构,化学性质比较稳定,但是稀有气体也能够发生反应,如Xe与氟气反应生成XeF2,故D错误;
故选C.
点评 本题考查较为综合,涉及同位素、原子结构、稀有气体性质等知识,题目难度不大,注意掌握常见原子的组成、结构,明确同位素的概念、稀有气体的性质,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
15. 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
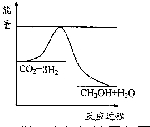
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2 和3mol H2.
 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2 和3mol H2.
16.下列分离方法中不正确的是( )
| A. | 利用萃取方法用四氯化碳提取溴水中的溴单质 | |
| B. | 利用蒸馏的方法可以分离沸点相差较大的液体混合物 | |
| C. | 利用分液的方法分离酒精和水 | |
| D. | 利用结晶的方法除去KNO3中的氯化钾 |
13.下列离子方程式书写正确的是( )
| A. | 铜跟浓硝酸反应:3Cu2+ 8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| B. | 大理石与醋酸反应:2H++CO32-═CO2↑+H2O | |
| C. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
17.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:K+、Na+、Cu2+、SO42- | |
| B. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| C. | 0.1 mol•L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- | |
| D. | 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
在通风厨中进行下列实验,下列说法不正确的是( )
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A.I中气体由无色变为红棕色的化学方程式:2NO+O2===2NO2
B.II中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C.对比I、II中的现象,说明稀HNO3的氧化性强于浓HNO3
D.针对III中的现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
 2,2二甲基丁烷.
2,2二甲基丁烷.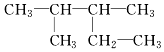 2,3二甲基戊烷.
2,3二甲基戊烷.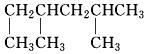 2,4二甲基己烷.
2,4二甲基己烷.

