题目内容
按要求填写除杂试剂及分离提纯的方法(括号中为杂质)
(1)CH4(C2H4):通过盛有 的洗气瓶
(2)乙醇(水):先加 后通过 来加以分离
(3)乙酸乙酯(乙酸):先加 后通过 法加以分离
(1)D元素的符号是O,C元素组成的单质C2的电子式是
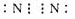 .
.(2)2016年10月17日7:30分在甘肃的酒泉卫星发射基地,我国成功发射“神舟十一号”载人飞船.火箭的发动机燃料更新为液态偏二甲肼(分子式为C2H8N2),氧化剂为液态的C2D4,燃烧后产物对环境无污染.写出偏二甲肼与C2D4反应的化学方程式:C2H8N2+2N2O4=3N2+4H2O+2CO2
(3)C2A4可作为火箭发动机的燃料,与氧化剂C2D4反应生成C2和A2D.已知:
①C2(g)+2D2(g)═C2D4(l)△H1═-19.5kJ/mol
②C2A4(l)+D2(g)═C2(g)+2A2D(g)△H2═-534.2kJ/mol
写出液体燃料C2A4与液态C2D4反应的热化学方程式:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
(4)在230℃和催化剂存在的条件下,将BD2与A2转化为BA3DA(g)和A2D(g).如图为生产1mol BA3DA(g)的能量变化示意图:
已知破坏1mol不同共价键的能量(kJ)分别是:
| B-A | B-D | B=D | A-A | A-D |
| 413.4 | 351 | 745 | 436 | 462.8 |
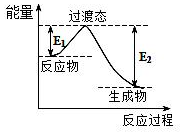
②已知E1=8.2kJ•mol-1,则E2=189.8kJ•mol-1.
| A. | ${\;}_{83}^{209}$Bi 和${\;}_{83}^{210}$Bi都含有83个中子 | |
| B. | 同位素:H2、D2、T2 | |
| C. | H2O和NH3分子中具有相同的质子数和电子数 | |
| D. | 稀有气体的原子最外层都达到8电子稳定结构,故都不能与别的物质发生反应 |
| A. | NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 在c(H+)=1×10-13mol•L-1的溶液中:Na+、Fe3+、Cl-、SO42-能大量共存 | |
| C. | 铜溶于FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+ | |
| D. | 向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42- |
NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出此化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液的变质情况。
限选试剂为:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、
澄清石灰水、饱和NaCl溶液
请完成下列探究实验方案。
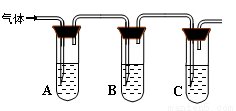
所加试剂 | 预期现象和结论 |
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
① 量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
② 滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;
2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O
③ 计算消毒液中NaC lO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
lO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。



 l·L-1
l·L-1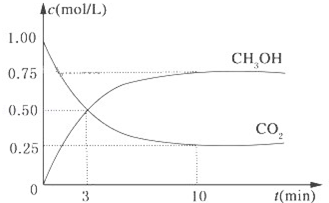 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.