题目内容
1.下列化合物电子式表示不正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.HCl为共价化合物,只含共价键;
B.二氧化碳为共价化合物,C、O之间含两对共用电子对;
C.过氧化钾为离子化合物,含离子键和O-O共价键;
D.水为共价化合物,只含O-H共价键.
解答 解:A.HCl为共价化合物,只含H-Cl键,电子式为 ,故A正确;
,故A正确;
B.二氧化碳为共价化合物,C、O之间含两对共用电子对,电子式为 ,故B错误;
,故B错误;
C.过氧化钾为离子化合物,含离子键和O-O共价键,电子式为 ,故C正确;
,故C正确;
D.水为共价化合物,只含O-H共价键,电子式为 ,故D正确;
,故D正确;
故选B.
点评 本题考查电子式,为高频考点,把握物质的结构、构成微粒、电子式的书写方法等为解答的关键,侧重分析与应用能力的考查,注意选项C中阴离子符号的书写,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
9.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO - | |
| B. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
16.下列盛放试剂或取用试剂的方法,正确的是( )
| A. | 浓硝酸或氢氟酸存放在配有磨口塞的棕色玻璃瓶中 | |
| B. | 汽油或煤油存放在带橡皮塞的棕色玻璃瓶中 | |
| C. | 用碱式滴定管准确量取25.00mL的KMnO4溶液 | |
| D. | 新制氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
6.下列关于0.10mol/L NaHCO3溶液的说法正确的是( )
| A. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)减小 |
13.乙醇、乙二醇( )、甘油(
)、甘油( )分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
 )、甘油(
)、甘油( )分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 4:3:2 |
10.下列都属于二次能源的是( )
| A. | 电能、蒸汽 | B. | 氢能、风能 | C. | 原煤、石油 | D. | 地热能、潮汐能 |
11.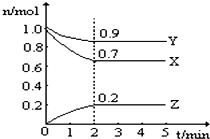 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
①该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.