题目内容
6.下列关于0.10mol/L NaHCO3溶液的说法正确的是( )| A. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)减小 |
分析 A.碳酸氢钠电离出的碳酸氢根离子不能拆开;
B.温度不变,水的离子积不变;
C.碳酸根离子带有2个单位负电荷,电荷守恒中其系数应该为2;
D.HCO3-水解为吸热反应,升高温度,促进水解.
解答 解:A.碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,正确的电离方程式为:NaHCO3═Na++HCO3-,故A错误;
B.25℃时,加水稀释后,水的离子积Kw=c(H+)•c(OH-)不变,故B正确;
C.根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.HCO3-水解为吸热反应,升高温度,促进水解,则c(HCO3-)减小,故D正确;
故选BD.
点评 本题考查较为综合,涉及电离方程式书写、水解原理及溶液中离子浓度关系的考查,题目难度不大,注意掌握盐的水解原理及其影响,明确电荷守恒的含义及应用方法.

练习册系列答案
相关题目
某次实验需要80ml1mol·L-1的NaCl溶液,现用NaCl粉末、蒸馏水配制。
(1)需要的仪器有托盘天平(带砝码)、烧杯、 、 、 和药匙。
(2)应称量NaCl粉末 g。
(3)假如其他操作均正确无误,分析下列情况对配制浓度的影响(填偏低、偏高或无影响)
A.定容时俯视观察刻度线 |
B.移液时,对用于溶解NaCl的烧杯没有洗涤 |
C.定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,又补加水至刻度线 |
D.原容量瓶洗净后未干燥 |
14.下列有关常见有机物的说法,不正确的是( )
| A. | 天然气和沼气的主要成分都是甲烷,甲烷是一种清洁能源 | |
| B. | 乙烯可以用作果实催熟剂,还可以用于合成有机高分子化合物 | |
| C. | 烷烃和苯通常容易发生取代反应,而烯烃则不能发生取代反应 | |
| D. | 某泸州老窖的瓶子标签上,注明52度,代表100mL该酒水中,含有52mL乙醇 |
1.下列化合物电子式表示不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
11.放射性同位素钬16667Ho 的原子核内的中子数是( )
| A. | 99 | B. | 67 | C. | 32 | D. | 166 |
18.下列说法正确的是( )
| A. | 苯酚、乙酸、苯磺酸都有酸性,它们都属于酸 | |
| B. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种化合物组成元素相同,各元素质量分数相同,则两者一定是同分异构体 | |
| D. | CO(NH2)2是第一种人工合成的有机物,与氰酸铵(NH4CNO)是同分异构体 |
15.在NH4Al(SO4)2溶液中,逐滴滴入Ba(OH)2溶液,沉淀的物质的量随Ba(OH)2溶液体积的变化如图,有关分析正确的是( )

| A. | O~M段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 沉淀的质量M>P | |
| C. | N点溶液可与Na+、Fe3+、NO3-、Cl-大量共存 | |
| D. | N~P段溶液的pH逐渐减小 |
16.某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据.表中数据为在不同条件下用10mL H2O2制取15OmLO2所需的时间(秒).
①上述实验结果体现了温度、催化剂、浓度等因素对过氧化氢分解速率的影响;
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率的影响温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快.
(2)某温度时,在一个2L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示.根据图中数据.试填写下列空白:
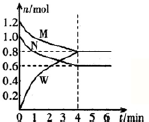
①该反应的化学方程式为M+N?2W.
②从开始至4min,N的平均反应速率为0.05mol/(L•min);4min 末M的转化率为33.3%.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据.表中数据为在不同条件下用10mL H2O2制取15OmLO2所需的时间(秒).
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率的影响温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快.
(2)某温度时,在一个2L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示.根据图中数据.试填写下列空白:

①该反应的化学方程式为M+N?2W.
②从开始至4min,N的平均反应速率为0.05mol/(L•min);4min 末M的转化率为33.3%.
