题目内容
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.
(1)用电离方程式解释NaHC2O4溶液显酸性的原因: ;
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接: ;
(3)配平以下氧化还原反应方程式:
□C2O42-+□MnO4-+□H+═□CO2↑+□Mn2++□H2O
(4)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为 mol;
②第二份溶液滴加0.10mol/L酸性KMnO4溶液至16mL时反应完全,该溶液中还原剂的物质的量为 mol.
(1)用电离方程式解释NaHC2O4溶液显酸性的原因:
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接:
(3)配平以下氧化还原反应方程式:
□C2O42-+□MnO4-+□H+═□CO2↑+□Mn2++□H2O
(4)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为
②第二份溶液滴加0.10mol/L酸性KMnO4溶液至16mL时反应完全,该溶液中还原剂的物质的量为
考点:离子浓度大小的比较,氧化还原反应方程式的配平,弱电解质在水溶液中的电离平衡
专题:氧化还原反应专题,电离平衡与溶液的pH专题
分析:(1)NaHC2O4溶液中,HC2O4-电离出氢离子,且电离程度大于其水解程度,溶液显示酸性;
(2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,二者恰好反应,所得溶液为草酸钠溶液,据此来确定离子浓度的大小;
(3)根据氧化还原反应得失电子守恒配平反应方程式;
(4)①根据n=cV计算出氢氧化钠的物质的量,然后再根据中和反应的实质计算出该溶液被中和的H+的物质的量;
②根据n=cV计算出高锰酸钾的物质的量,然后根据反应的化学方程式进行计算.
(2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,二者恰好反应,所得溶液为草酸钠溶液,据此来确定离子浓度的大小;
(3)根据氧化还原反应得失电子守恒配平反应方程式;
(4)①根据n=cV计算出氢氧化钠的物质的量,然后再根据中和反应的实质计算出该溶液被中和的H+的物质的量;
②根据n=cV计算出高锰酸钾的物质的量,然后根据反应的化学方程式进行计算.
解答:
解:(1)NaHC2O4溶液中存在电离平衡:HC2O4-?H++C2O42-,电离程度大于水解程度,溶液显示酸性,
故答案为:HC2O4-?H++C2O42-;
(2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,二者恰好反应,所得溶液为草酸钠溶液,在该溶液中,直接电离出的钠离子和草酸根浓度最大,但是草酸根会水解,所以c(Na+)>c(C2O42-),草酸根水解生成草酸氢根和氢氧根,溶液显碱性,水电离会生成一部分氢氧根,所以c(OH-)>c(HC2O4-)>c(H+),
故答案为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(3)高锰酸根离子变成锰离子,化合价有+7变为+2,化合价降低5价,草酸根离子从+3变为+4,化合价升高1价,每个草酸根离子含有2个C,化合价升高了2价,根据化合价升降相等可得二者的关系式为:2MnO4-~5C2O42-,再根据电荷守恒和质量守恒可写出反应方程式为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,
故答案为:5;2;16;10;2;8;
(4)①根据中和反应的实质知道氢离子的物质的量即为氢氧化钠的物质的量,即0.25mol/L×0.02L=0.005mol,
故答案为:0.005;
②氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,即消耗高锰酸根离子0.10mol/L×0.016L=0.0016mol,所以该溶液中还原剂的物质的量为
=4×10-3mol,
故答案为:4×10-3.
故答案为:HC2O4-?H++C2O42-;
(2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,二者恰好反应,所得溶液为草酸钠溶液,在该溶液中,直接电离出的钠离子和草酸根浓度最大,但是草酸根会水解,所以c(Na+)>c(C2O42-),草酸根水解生成草酸氢根和氢氧根,溶液显碱性,水电离会生成一部分氢氧根,所以c(OH-)>c(HC2O4-)>c(H+),
故答案为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(3)高锰酸根离子变成锰离子,化合价有+7变为+2,化合价降低5价,草酸根离子从+3变为+4,化合价升高1价,每个草酸根离子含有2个C,化合价升高了2价,根据化合价升降相等可得二者的关系式为:2MnO4-~5C2O42-,再根据电荷守恒和质量守恒可写出反应方程式为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,
故答案为:5;2;16;10;2;8;
(4)①根据中和反应的实质知道氢离子的物质的量即为氢氧化钠的物质的量,即0.25mol/L×0.02L=0.005mol,
故答案为:0.005;
②氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,即消耗高锰酸根离子0.10mol/L×0.016L=0.0016mol,所以该溶液中还原剂的物质的量为
| 0.0016mol×5 |
| 2 |
故答案为:4×10-3.
点评:本题考查了溶液中离子浓度大小比较、氧化还原反应的配平、离子反应的计算等知识,题目难度中等,试题综合性较强,涉及的知识点较多,注意掌握氧化还原反应的实质及配平方法,明确判断溶液中离子浓度大小的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图为反应N2+3H2?2NH3的速率V(N2)变化的图象,则横坐标不可能是( )


| A、反应时间 |
| B、温度 |
| C、压强 |
| D、N2的浓度 |
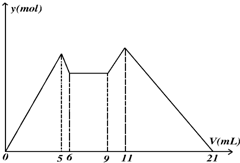 如图所示,是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,6ml后继续滴加A若干,之后改滴试剂B,所得 沉淀ymol 与试剂体积V(ml)间的关系.以下结论错误的是( )
如图所示,是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,6ml后继续滴加A若干,之后改滴试剂B,所得 沉淀ymol 与试剂体积V(ml)间的关系.以下结论错误的是( )| A、从6到9,相应离子反应式H++OH-=H2O |
| B、原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 |
| C、A可能是NaOH,B可能是盐酸,且c(NaOH):c(HCl)=1:2 |
| D、若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 |
1mol Na2O2与2mol NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
| A、Na2CO3 |
| B、Na2O2、Na2CO3 |
| C、NaOH、Na2CO3 |
| D、Na2O2、NaOH、Na2CO3 |
 烧杯A中盛放0.1mol?L-1的H2SO4溶液,烧杯B中盛放0.1mol?L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法正确的是( )
烧杯A中盛放0.1mol?L-1的H2SO4溶液,烧杯B中盛放0.1mol?L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法正确的是( )| A、A为电解池,B为原电池 |
| B、Fe电极发生还原反应 |
| C、当A烧杯中产生0.1 mol气体,B烧杯中产生气体也为0.1mol |
| D、一段时间后,B烧杯中溶液的浓度增大 |
要检验久置的FeSO4 溶液是否含有Fe2(SO4)3,应选用的试剂是( )
| A、KSCN溶液 | B、KI溶液 |
| C、氨水 | D、Fe粉 |