题目内容
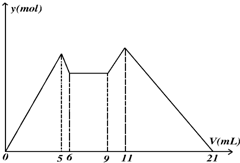 如图所示,是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,6ml后继续滴加A若干,之后改滴试剂B,所得 沉淀ymol 与试剂体积V(ml)间的关系.以下结论错误的是( )
如图所示,是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,6ml后继续滴加A若干,之后改滴试剂B,所得 沉淀ymol 与试剂体积V(ml)间的关系.以下结论错误的是( )| A、从6到9,相应离子反应式H++OH-=H2O |
| B、原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 |
| C、A可能是NaOH,B可能是盐酸,且c(NaOH):c(HCl)=1:2 |
| D、若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 |
考点:有关混合物反应的计算
专题:计算题
分析:由图可知,加入试剂A会产生沉淀,且部分沉淀溶于试剂A,试剂A为强碱,6ml后继续滴加A若干,之后改滴试剂B,先沉淀不变,而后沉淀量增大,最后完全消失,则B为强酸.
A.从6到9沉淀的量未发生变化,发生酸碱中和反应;
B.开始加入碱,生成沉淀与氢氧化铝溶解消耗碱的体积之比为5:1,设溶解氢氧化铝消耗OH-为1mol,则生成沉淀最大时,消耗OH-为5mol,计算氢氧化铝的物质的量,进而计算氢氧化镁物质的量,根据守恒计算n(Al3+)、n(Mg2+),根据电荷守恒计算n(Cl-),进而计算浓度之比;
C.结合B中分析,计算9-11mL消耗HCl的物质的量,进而确定氢氧化钠与盐酸的浓度之比;
D.6~9mL之间为碱与酸反应,根据C中计算NaOH与HCl的浓度之比计算该3mL中NaOH溶液、盐酸的体积,进而计算整个过程中消耗NaOH溶液、盐酸的总体积,据此解答.
A.从6到9沉淀的量未发生变化,发生酸碱中和反应;
B.开始加入碱,生成沉淀与氢氧化铝溶解消耗碱的体积之比为5:1,设溶解氢氧化铝消耗OH-为1mol,则生成沉淀最大时,消耗OH-为5mol,计算氢氧化铝的物质的量,进而计算氢氧化镁物质的量,根据守恒计算n(Al3+)、n(Mg2+),根据电荷守恒计算n(Cl-),进而计算浓度之比;
C.结合B中分析,计算9-11mL消耗HCl的物质的量,进而确定氢氧化钠与盐酸的浓度之比;
D.6~9mL之间为碱与酸反应,根据C中计算NaOH与HCl的浓度之比计算该3mL中NaOH溶液、盐酸的体积,进而计算整个过程中消耗NaOH溶液、盐酸的总体积,据此解答.
解答:
解:由图可知,加入试剂A会产生沉淀,且部分沉淀溶于试剂A,试剂A为强碱,6ml后继续滴加A若干,之后改滴试剂B,先沉淀不变,而后沉淀量增大,最后完全消失,则B为强酸.
A.从6到9沉淀的量未发生变化,发生酸碱中和反应,离子反应式为:H++OH-=H2O,故A正确;
B.开始加入碱,生成沉淀与氢氧化铝溶解消耗碱的体积之比为5:1,设溶解氢氧化铝消耗OH-为1mol,则生成沉淀最大时,消耗OH-为5mol,由Al(OH)3+OH-=AlO2-+2H2O,可知n[Al(OH)3]=n(OH-)=1mol,故n(Al3+)=n[Al(OH)3]=1mol,生成氢氧化铝沉淀消耗OH-为1mol×3=3mol,则生成氢氧化镁消耗OH-为5mol-3mol=2mol,故n[Mg(OH)2]=1mol,则n(Mg2+)=n[Mg(OH)2]=1mol,由电荷守恒可知n(Cl-)=3n(Al3+)+2n(Mg2+)=5mol,故原混合溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B正确;
C.由B中分析可知,溶解氢氧化铝消耗NaOH为1mol,而n(AlO2-)=1mol,由AlO2-+H++H2O=Al(OH)3↓,可知消耗n(H+)=1mol,溶解氢氧化铝消耗氢氧化钠溶液体积与生成氢氧化铝沉淀消耗盐酸体积之比为1:2,故c(NaOH):c(HCl)=2:1,故C错误;
D.6~9mL之间为碱与酸反应,由于c(NaOH):c(HCl)=2:1,二者物质的量相等,故二者体积之比为1:2,则发生中和反应的NaOH溶液体积为3mL×
=1mL,盐酸为3mL-1mL=2mL,故整个过程中NaOH溶液总体积为6mL+1mL=7mL,盐酸总体积为2mL+(21-9)mL=13mL,则V(A):V(B)=7:13,故D正确,
故选C.
A.从6到9沉淀的量未发生变化,发生酸碱中和反应,离子反应式为:H++OH-=H2O,故A正确;
B.开始加入碱,生成沉淀与氢氧化铝溶解消耗碱的体积之比为5:1,设溶解氢氧化铝消耗OH-为1mol,则生成沉淀最大时,消耗OH-为5mol,由Al(OH)3+OH-=AlO2-+2H2O,可知n[Al(OH)3]=n(OH-)=1mol,故n(Al3+)=n[Al(OH)3]=1mol,生成氢氧化铝沉淀消耗OH-为1mol×3=3mol,则生成氢氧化镁消耗OH-为5mol-3mol=2mol,故n[Mg(OH)2]=1mol,则n(Mg2+)=n[Mg(OH)2]=1mol,由电荷守恒可知n(Cl-)=3n(Al3+)+2n(Mg2+)=5mol,故原混合溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B正确;
C.由B中分析可知,溶解氢氧化铝消耗NaOH为1mol,而n(AlO2-)=1mol,由AlO2-+H++H2O=Al(OH)3↓,可知消耗n(H+)=1mol,溶解氢氧化铝消耗氢氧化钠溶液体积与生成氢氧化铝沉淀消耗盐酸体积之比为1:2,故c(NaOH):c(HCl)=2:1,故C错误;
D.6~9mL之间为碱与酸反应,由于c(NaOH):c(HCl)=2:1,二者物质的量相等,故二者体积之比为1:2,则发生中和反应的NaOH溶液体积为3mL×
| 1 |
| 3 |
故选C.
点评:本题考查混合物计算、对图象的分析处理能力等,正确判断各阶段发生的反应是关键,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
三鹿奶粉事件发生后,党中央、国务院高度重视,作出了重大部署,对婴幼儿奶粉进行了三聚氰胺全国专项监督检查,其结果让人震惊.已知三聚氰胺的分子式是C3N6H6,下列有关说法正确的是( )
| A、三聚氰胺的摩尔质量为126g |
| B、1mol三聚氰胺的质量为126g |
| C、三聚氰胺中N的质量分数为80% |
| D、1mol三聚氰胺有15个原子 |
下列不属于氧化还原反应的是( )
A、Mg+CO2
| ||||
| B、Mg(OH)2+2HCl=MgCl2+2H2O | ||||
C、2Al+Fe2O3
| ||||
D、H2+CuO
|
已知A、B、C、D之间的转化关系为:A+B→C+D,则下列有关说法不正确的是( )
| A、若A为Fe,D为氢气,则B可能是酸,也可能是水 |
| B、若A、D为化合物,B为水,则C可能是气体单质,也可能是化合物 |
| C、若A、B、C、D均为化合物,该反应一定属于复分解反应 |
| D、若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D 在常温下一定呈液态 |