题目内容
重晶石(BaSO4)是重要的化工原料,制备氢氧化钡晶体(Ba(OH)2?8H2O)的流程如下:
已知:Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
(1)写出煅烧时发生反应的热化学方程式: .
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式: .
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PdCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式: .
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3.发生的反应可表示为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),现有0.20mol BaSO4,加入1.0L 2.0mol?L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量.(写出计算过程,结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因: .

已知:Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
(1)写出煅烧时发生反应的热化学方程式:
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PdCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3.发生的反应可表示为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),现有0.20mol BaSO4,加入1.0L 2.0mol?L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量.(写出计算过程,结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:
考点:热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质
专题:氧化还原反应专题,电离平衡与溶液的pH专题
分析:(1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)氢氧化钡晶体与氯化铵晶体混合反应生成氯化钡、氨气和水;
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PdCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,气体为二氧化碳,由题意“CO与 PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加”,可知反应物为CO、PdCl2、H2O;然后根据质量守恒定律及常见物质的组成判断生成物;
(4)设发生转化的BaSO4的物质的量为x mol,则平衡时c(SO42-)为x mol/L,利用三段式计算平衡时碳酸根的浓度,代入平衡常数计算;
(5)依据沉淀溶解平衡平衡移动游戏因素分析,结合溶度积常数分析判断.
(2)氢氧化钡晶体与氯化铵晶体混合反应生成氯化钡、氨气和水;
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PdCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,气体为二氧化碳,由题意“CO与 PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加”,可知反应物为CO、PdCl2、H2O;然后根据质量守恒定律及常见物质的组成判断生成物;
(4)设发生转化的BaSO4的物质的量为x mol,则平衡时c(SO42-)为x mol/L,利用三段式计算平衡时碳酸根的浓度,代入平衡常数计算;
(5)依据沉淀溶解平衡平衡移动游戏因素分析,结合溶度积常数分析判断.
解答:
解:(1)①Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ?mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
③Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
依据盖斯定律②×2+③-①得到:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1 ;
(2)氢氧化钡晶体与氯化铵晶体混合反应生成氯化钡、氨气和水,反应的化学方程式为:Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(3)由题意“CO与 PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加”,可知反应物为CO、PdCl2、H2O;根据质量守恒定律及常见物质的组成可推出生成物为:黑色金属钯粉末、氯化氢、二氧化碳,故可书写此反应的化学方程式为:CO+PdCl2+H2O═2HCl+Pd↓+CO2,
故答案为:CO+PdCl2+H2O=Pd↓+CO2+2HCl;
(4)设发生转化的BaSO4的物质的量为x,则平衡时c(SO42-)为x mol?L-1
BaSO4+CO32-?BaCO3+SO42-
起始浓度(mol?L-1):2.0 0
转化浓度(mol?L-1):x x
平衡浓度(mol?L-1):(2.0-x) x
K=
=
=4.0×10-2
x=7.7×10-2 mol,
答:发生转化的BaSO4的物质的量为7.7×10-2 mol;
(5)BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),加入饱和碳酸钠溶液,CO32-浓度增大,c(Ba2+)×c(CO32-)>Ksp(BaCO3),生成BaCO3沉淀,c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3,
故答案为:BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),加入饱和碳酸钠溶液,CO32-浓度增大,c(Ba2+)×c(CO32-)>Ksp(BaCO3),生成BaCO3沉淀,c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3.
②2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
③Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
依据盖斯定律②×2+③-①得到:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1 ;
(2)氢氧化钡晶体与氯化铵晶体混合反应生成氯化钡、氨气和水,反应的化学方程式为:Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(3)由题意“CO与 PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加”,可知反应物为CO、PdCl2、H2O;根据质量守恒定律及常见物质的组成可推出生成物为:黑色金属钯粉末、氯化氢、二氧化碳,故可书写此反应的化学方程式为:CO+PdCl2+H2O═2HCl+Pd↓+CO2,
故答案为:CO+PdCl2+H2O=Pd↓+CO2+2HCl;
(4)设发生转化的BaSO4的物质的量为x,则平衡时c(SO42-)为x mol?L-1
BaSO4+CO32-?BaCO3+SO42-
起始浓度(mol?L-1):2.0 0
转化浓度(mol?L-1):x x
平衡浓度(mol?L-1):(2.0-x) x
K=
| c(SO42-) |
| c(CO32-) |
| x |
| 2.0-x |
x=7.7×10-2 mol,
答:发生转化的BaSO4的物质的量为7.7×10-2 mol;
(5)BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),加入饱和碳酸钠溶液,CO32-浓度增大,c(Ba2+)×c(CO32-)>Ksp(BaCO3),生成BaCO3沉淀,c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3,
故答案为:BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),加入饱和碳酸钠溶液,CO32-浓度增大,c(Ba2+)×c(CO32-)>Ksp(BaCO3),生成BaCO3沉淀,c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3.
点评:本题考查热化学方程式的书写、影响化学平衡的因素、化学平衡常数有关计算、沉淀转化等,难度中等,本题综合性较大,是对热点知识的考查.

练习册系列答案
相关题目
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A、溶液中碳酸氢根电离的氢离子浓度为10-10mol?L-1 |
| B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C、溶液中水电离的氢氧根离子浓度为10-4mol?L-1 |
| D、c(Na+)+c(H+)=c(HCO3-)+c(OH-) |
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的( )
| A、分子数和气体质量均不同 |
| B、分子数和电子数均相同 |
| C、质子数和中子数均相同 |
| D、分子数、原子数和中子数均相同 |
据图判断下列说法不正确的是( )
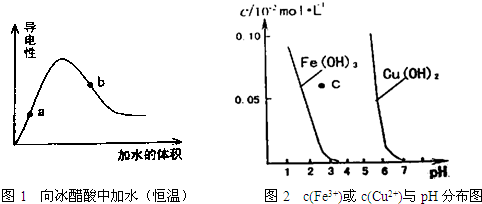

| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:a点的比b点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调PH约为4左右 |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、25℃时,pH=13的Na2CO3溶液中由水电离出的OH-数目为0.1NA |
| C、0.1 mol C12H22O11在一定条件下完全水解生成的葡萄糖分子数目为0.2NA |
| D、4.6 g金属钠与足量氧气反应被氧化成Na2O和Na2O2,生成物中阴离子个数为0.1NA |



 FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.