题目内容
10.下列反应的离子方程式正确的是( )| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
分析 A.氢氧化钠过量反应生成碳酸钙、碳酸钠和水;
B.酸性环境下不能生成氢氧根离子;
C.二者反应生成氢氧化铝沉淀、氯化钠和氢气;
D.氯气少量只氧化二价铁离子;
解答 解:A.Ca(HCO2)2溶液中加入过量NaOH溶液,离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故A错误;
B.酸性条件下KIO3溶液与KI溶液反应,离子方程式:IO3-+5I-+6H+═3I2+3H2O,故B错误;
C.AlCl3溶液中加入少量Na,离子方程式:2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑,故C正确;
D.FeBr2溶液中通入少量Cl2,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循电荷守恒,注意二价铁离子、溴离子还原性强弱,题目难度中等.

练习册系列答案
相关题目
20.氮化铝具有耐高温、抗冲击、导热性好等优良性能,在电子工业、陶瓷工业等领域有广泛应用.其合成反应为:Al2O3+N2+3C=2AlN+3CO,下列说法不正确的是( )
| A. | C作还原剂,在反应中被氧化 | |
| B. | 每转移2mol e-时,可产生1mol CO | |
| C. | N2作氧化剂,AlN是还原产物 | |
| D. | 欲制得2molAlN,实际消耗N2体积大于22.4L |
1.常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A. | c(CH3COO-)>c(Na+) | B. | c(CH3COO-<c(Na+) | ||
| C. | c(CH3COO-)=c(Na+) | D. | 无法确定c(CH3COO-)与c(Na+)的关系 |
18.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
5.化学与生产、生活密切相关.下列叙述中,不正确的是( )
| A. | 二氧化碳和甲烷均是造成温室效应的气体 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | 漂白液的有效成分是NaClO,制作计算机芯片的材料是SiO2晶体 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除铁锈 |
15. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
(1)已知25℃时,①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7 kJ/mol,
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1.
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-)
C.$\frac{c({H}^{+})}{c({H}^{-})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
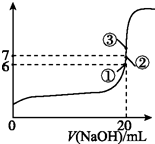
(3)在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol/L
(4)物质的量浓度均为0.1 mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液④NaClO溶液.依据数据判断pH由大到小的顺序是①>④>②>③.
(5)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1 mol HF转移1mol电子.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1.
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-)
C.$\frac{c({H}^{+})}{c({H}^{-})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol/L
(4)物质的量浓度均为0.1 mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液④NaClO溶液.依据数据判断pH由大到小的顺序是①>④>②>③.
(5)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1 mol HF转移1mol电子.
2.下列关于有机化合物的说法正确的是( )
| A. | 日常生活中常用无水乙醇做消毒剂 | |
| B. | 乙烯和苯都可以发生加成反应,都可以通过石油分馏得到 | |
| C. | 等物质的量的乙烯和乙醇完全燃烧时消耗氧气的质量相等 | |
| D. | 糖类、油脂、蛋白质都可以水解 |
8. 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液,加入1-2滴酚酞试剂
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF,本实验中的标准溶液装在图中的乙中,若某实验中需要用高锰酸钾进行滴定,则选择图中的甲.
(2)上述(B)操作的目的是防止将标准液稀释.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)偏大.
(4)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是偏小.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏大
(7)滴定结果
则该盐酸的浓度为0.08mol/L.
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取25.00mL待测的盐酸溶液,加入1-2滴酚酞试剂
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF,本实验中的标准溶液装在图中的乙中,若某实验中需要用高锰酸钾进行滴定,则选择图中的甲.
(2)上述(B)操作的目的是防止将标准液稀释.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)偏大.
(4)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是偏小.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏大
(7)滴定结果
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |