题目内容
(1)用电子式表示H2O和NaCl的形成过程 ; .
(2)CO2以 键结合,MgCl2以 键结合.(填极性键、非极性键、离子键)
(2)CO2以
考点:化学键,离子键的形成,共价键的形成及共价键的主要类型
专题:
分析:(1)氢原子和氧原子之间以共用电子对而形成水分子,氯离子和钠离子之间以离子键形成氯化钠;
(2)不同非金属元素之间易形成极性键,活泼金属和活泼非金属元素之间易形成离子键.
(2)不同非金属元素之间易形成极性键,活泼金属和活泼非金属元素之间易形成离子键.
解答:
解:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,
,
NaCl为离子化合物,用电子式表示形成过程为 ,
,
故答案为: ,
,
 ;
;
(2)二氧化碳分子中碳原子和氧原子之间形成极性键,氯化镁中镁离子和氯离子之间形成离子键,故答案为:极性键;离子键.
 ,
,NaCl为离子化合物,用电子式表示形成过程为
 ,
,故答案为:
 ,
, ;
;(2)二氧化碳分子中碳原子和氧原子之间形成极性键,氯化镁中镁离子和氯离子之间形成离子键,故答案为:极性键;离子键.
点评:本题考查了离子键、共价键的判断及用电子式书写化合物的性质过程,明确化合物中存在的化学键是解本题关键,难点是用电子式表示化合物的形成过程.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
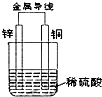 如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )| A、能将电能转换为化学能 |
| B、溶液会逐渐变为蓝色 |
| C、锌片是负极,发生氧化反应 |
| D、外电路中电子由铜片经导线流向锌片 |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、0.1 mol Fe与足量的氯气反应时失去的电子数为0.2NA |
| B、标准状况下22.4L SO3含有的分子数为NA |
| C、6gSiO2晶体中含有的硅氧键数目为0.4NA |
| D、用Pt做电极电解硫酸铜溶液,当阳极产生的气体在标准状况下为22.4L时,转移电子数目为2NA |
电池在生产、生活中应用越来越广泛.下列说法错误的是( )
| A、化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电 |
| B、铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大 |
| C、燃料电池具有能量利用率高、可连续使用和污染轻等优点 |
| D、锂电池是一种高能电池,体积小、重量轻,单位质量能量比高 |
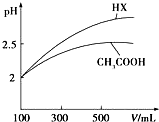 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示: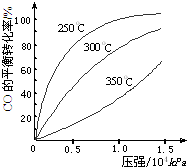 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.