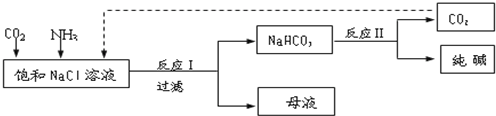
题目内容
镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应方程式:Mg+2H++H2O2═Mg2++2H2O.关于该电池说法正确的是( )
| A、镁合金为电池负极,发生还原反应 |
| B、放电时H2O2在正极反应得电子 |
| C、正极反应式为:Mg-2e-═Mg2+ |
| D、放电时正极附近的酸性增强 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:镁燃料电池中,负极金属镁发生失电子的氧化反应,正极是双氧水发生得电子得还原反应,可以根据两极区附近氢离子和氢氧根离子之间的变化来确定溶液酸碱性的变化.
解答:
解:A、根据总反应:Mg+2H++H2O2=Mg2++2H2O,则负极是金属镁发生失电子的氧化反应,故A错误;
B、根据总反应:Mg+2H++H2O2=Mg2++2H2O,则正极是双氧水发生得电子得还原反应,双氧水被还原,故B正确;
C、根据总反应:Mg+2H++H2O2=Mg2++2H2O,则负极是金属镁发生失电子的氧化反应,即Mg-2e-=Mg2+,故C错误;
D、根据放电时正极反应为:2e-+2H++H2O2=2H2O,则正极上氢离子浓度减小,溶液酸性减弱,故D错误.
故选B.
B、根据总反应:Mg+2H++H2O2=Mg2++2H2O,则正极是双氧水发生得电子得还原反应,双氧水被还原,故B正确;
C、根据总反应:Mg+2H++H2O2=Mg2++2H2O,则负极是金属镁发生失电子的氧化反应,即Mg-2e-=Mg2+,故C错误;
D、根据放电时正极反应为:2e-+2H++H2O2=2H2O,则正极上氢离子浓度减小,溶液酸性减弱,故D错误.
故选B.
点评:本题考查原电池的工作原理,题目难度不大,本题注意把握电极反应式的书写,正确判断离子的定向移动.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
下列实验操作中不正确的是(多选) ( )
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
以下化石能源的加工所得产品不符合事实的是( )
| A、石油分馏-丙炔 |
| B、石油裂解-乙烯 |
| C、石油裂化-汽油 |
| D、天然气热分解-炭黑 |
如图是周期表中短周期的一部分,A、C的原子序数之和等于B原子的原子序数.下列叙述正确的是( )
| A | C | |
| B |
| A、B的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中C的氢化物稳定性最好 |
| C、原子半径大小关系为:C>A |
| D、C的单质常温下为无色无味的气体 |
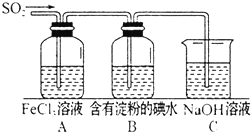 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: