题目内容
浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下).已知:Cu+2H2SO4
CuSO4+SO2↑+2H2O.试计算:
(1)反应中消耗的铜的质量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中CuSO4的物质的量浓度是多少?
| ||
(1)反应中消耗的铜的质量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中CuSO4的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:计算题
分析:计算氢气的物质的量,再根据方程式计算消耗Cu的物质的量、生成硫酸铜的物质的量,根据c=
计算CuSO4的物质的量浓度.
| n |
| V |
解答:
解:标况下,3.36L二氧化硫的物质的量为
=0.15mol,
Cu+2H2SO4
CuSO4+SO2↑+2H2O
1 1 1
n(Cu) n(CuSO4) 0.15mol
n(Cu)=n(CuSO4)=n(SO2)=0.15mol
故生成的硫酸铜配制成500mL溶液,该溶液中CuSO4的物质的量浓度为
=0.3mol/L,
答:(1)消耗Cu的物质的量为0.15mol;
(2)溶液中CuSO4的物质的量浓度为0.3mol/L.
| 3.36L |
| 22.4L/mol |
Cu+2H2SO4
| ||
1 1 1
n(Cu) n(CuSO4) 0.15mol
n(Cu)=n(CuSO4)=n(SO2)=0.15mol
故生成的硫酸铜配制成500mL溶液,该溶液中CuSO4的物质的量浓度为
| 0.15mol |
| 0.5L |
答:(1)消耗Cu的物质的量为0.15mol;
(2)溶液中CuSO4的物质的量浓度为0.3mol/L.
点评:本题考查化学方程式有关计算、物质的量有关计算,侧重考查学生对基础知识的巩固.

练习册系列答案
相关题目
生产、生活离不开各种化学物质,下列说法不正确的是( )
| A、不需要通过化学反应就能从海水中获得食盐和淡水 |
| B、潜水艇在紧急情况下可用过氧化钠供氧 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、“加碘盐”、“高钙牛奶”、“补铁营养品”等食品中的碘、钙、铁是指单质 |
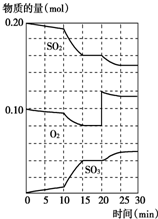 600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )
600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )| A、反应从开始到第一次平衡时,二氧化硫的转化率为20% |
| B、10~15 min和20~25min相比,前者的化学反应速率大 |
| C、反应进行至20min时,曲线发生变化是因为通入了氧气 |
| D、反应进行到10min~15 min的曲线变化原因一定是增大了压强 |
我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.如图是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液
A和食盐的饱和溶液
悬浊液
晶体
纯碱,则下列叙述错误的是( )
| 加入食盐 |
| Ⅰ |
| 通入足量气体B |
| Ⅱ |
| 过滤 |
| Ⅲ |
| Ⅳ |
| A、A气体是NH3,B气体是CO2 |
| B、第Ⅲ步得到的晶体是发酵粉的主要成分 |
| C、第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
化学中常借助于图象这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理.下列有关化学图象表现的内容正确的是( )
A、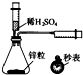 测定一定时间内生成H2的反应速率 |
B、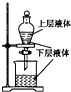 提取海带中的碘 |
C、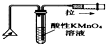 检验火柴燃烧产生的SO2 |
D、 证明非金属性:Cl>C>Si |
尼龙是某种合成有机高分子化合物,已知尼龙-66的结构简式为 ,
,
其单体的结构简式应为( )
 ,
,其单体的结构简式应为( )
| A、HOOCCH2CH2CH2CH2CH2CH2COOH和H2NCH2CH2CH2CH2CH2CH2NH2 |
| B、HOOCCH2CH2CH2CH2CH2CH2COOH和H2NCH2CH2CH2CH2NH2 |
| C、HOOCCH2CH2CH2CH2CH2CH2NH2 |
| D、HOOCCH2CH2CH2CH2COOH和H2NCH2CH2CH2CH2CH2CH2NH2 |
镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应方程式:Mg+2H++H2O2═Mg2++2H2O.关于该电池说法正确的是( )
| A、镁合金为电池负极,发生还原反应 |
| B、放电时H2O2在正极反应得电子 |
| C、正极反应式为:Mg-2e-═Mg2+ |
| D、放电时正极附近的酸性增强 |