题目内容
A~D为短周期元素,其性质或结构信息如表所示:
请根据表中信息回答下列问题:
(1)A元素在元素周期表中的位置是 ,能说明A单质与D单质氧化性相对强弱的离子方程式为 .
(2)B的单质与大多数同类的物质相比较在化学性质上有一些不同之处,请说明其中一点(用文字或化学方程式表述) .
(3)A与C形成化合物的电子式为 .
(4)B和D形成的化合物只能用干法制取,写出该方法的化学方程式 .
| 元素 | A | B | C | D |
| 相关 信息 |
其单质是一种本身有毒又可用来消毒的有色气体 | 其单质既有金属性,又有一定的非金属性(但属于金属) | 其最外层电子数是电子层数的2倍,且能形成熔点高硬度大的稳定单质 | 其简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里 |
(1)A元素在元素周期表中的位置是
(2)B的单质与大多数同类的物质相比较在化学性质上有一些不同之处,请说明其中一点(用文字或化学方程式表述)
(3)A与C形成化合物的电子式为
(4)B和D形成的化合物只能用干法制取,写出该方法的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A~D为短周期元素,A单质是一种本身有毒又可用来消毒的有色气体,则A为Cl;B单质既有金属性,又有一定的非金属性(但属于金属),则B为Al;C元素原子最外层电子数是电子层数的2倍,为C元素或S硫元素,且能形成熔点高硬度大的稳定单质,则C为碳元素;D的简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里,则D为S,据此解答.
解答:
解:A~D为短周期元素,A单质是一种本身有毒又可用来消毒的有色气体,则A为Cl;B单质既有金属性,又有一定的非金属性(但属于金属),则B为Al;C元素原子最外层电子数是电子层数的2倍,为C元素或S硫元素,且能形成熔点高硬度大的稳定单质,则C为碳元素;D的简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里,则D为S,
(1)A为Cl元素,在元素周期表中的位置是第三周期ⅦA族,能说明A单质(氯气)与D单质(硫)氧化性相对强弱的离子方程式为:Cl2+S2-═2Cl-+S↓,
故答案为:第三周期ⅦA族;Cl2+S2-═2Cl-+S↓;
(2)B为Al,属于两性金属,能与强碱反应生成偏铝酸盐与氢气,而其他金属大多不能,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)A与C形成化合物为CCl4,电子式为 ,故答案为:
,故答案为: ;
;
(4)B和D形成的化合物为Al2S3,只能用干法制取,该方法的化学方程式为:2Al+3S
Al2S3 ,
故答案为:2Al+3S
Al2S3 .
(1)A为Cl元素,在元素周期表中的位置是第三周期ⅦA族,能说明A单质(氯气)与D单质(硫)氧化性相对强弱的离子方程式为:Cl2+S2-═2Cl-+S↓,
故答案为:第三周期ⅦA族;Cl2+S2-═2Cl-+S↓;
(2)B为Al,属于两性金属,能与强碱反应生成偏铝酸盐与氢气,而其他金属大多不能,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)A与C形成化合物为CCl4,电子式为
 ,故答案为:
,故答案为: ;
;(4)B和D形成的化合物为Al2S3,只能用干法制取,该方法的化学方程式为:2Al+3S
| ||
故答案为:2Al+3S
| ||
点评:本题考查结构性质位置关系应用,难度不大,侧重对基础知识的考查,(3)中电子式为易错点,学生容易忽略Cl原子未参与成键的孤对电子.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
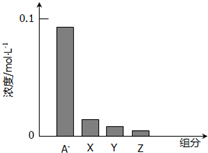 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A、HA为强酸 |
| B、该混合液pH=7 |
| C、图中X表示HA,Y表示OH-,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)=c(Na+) |
将2.06g NaBr和0.42g NaF溶于水形成混合溶液,加足量的AgNO3溶液得到沉淀3.76g.下面叙述正确的是( )
| A、溴化钠只有一部分反应,氟化钠未反应 |
| B、氟化银溶于水 |
| C、沉淀是氟化银 |
| D、沉淀是氟化银与溴化银的混合物 |
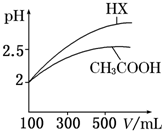 回答下列问题:
回答下列问题: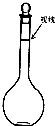 实验室要配制480mL0.2mol/L NaOH溶液,请回答下列问题:
实验室要配制480mL0.2mol/L NaOH溶液,请回答下列问题: