题目内容
将2.06g NaBr和0.42g NaF溶于水形成混合溶液,加足量的AgNO3溶液得到沉淀3.76g.下面叙述正确的是( )
| A、溴化钠只有一部分反应,氟化钠未反应 |
| B、氟化银溶于水 |
| C、沉淀是氟化银 |
| D、沉淀是氟化银与溴化银的混合物 |
考点:氯、溴、碘及其化合物的综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:卤族元素
分析:AgBr不溶于水,而AgF易溶于水,n(NaBr)=
=0.02mol,若沉淀只有AgBr,则n(AgBr)=
=0.02mol,以此来解答.
| 2.06g |
| 103g/mol |
| 3.76g |
| 188g/mol |
解答:
解:n(NaBr)=
=0.02mol,若沉淀只有AgBr,则n(AgBr)=
=0.02mol,溴原子守恒,
说明沉淀只有AgBr,且NaBr完全反应,而NaF不反应,因AgF溶于水,
故选B.
| 2.06g |
| 103g/mol |
| 3.76g |
| 188g/mol |
说明沉淀只有AgBr,且NaBr完全反应,而NaF不反应,因AgF溶于水,
故选B.
点评:本题考查难溶电解质知识,为高频考点,把握溴原子守恒及常见卤化银的性质为解答的关键,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列物质的化学用语表达正确的是( )
A、甲烷的球棍模型: |
| B、(CH3)3COH的名称:2,2二甲基乙醇 |
| C、乙醛的结构式:CH3CHO |
D、羟基的电子式: |
用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是Cl2( )
A、Cu
| ||||
B、Cu
| ||||
C、Cu
| ||||
D、Cu
|
0.1mol阿斯匹林(结构简式为 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A、0.1mol |
| B、0.2 mol |
| C、0.4 mol |
| D、0.3 mol |
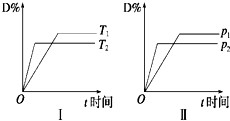 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )| A、化学方程式中化学计量数:m>p+q |
| B、降温可使化学平衡向正反应方向移动 |
| C、使用合适的催化剂可使D%有所增加 |
| D、B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,25℃时氯气-氯水体系中存在以下平衡关系:Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示,下列表述正确的是( )
| A、Cl2(g)+H2O?2H++ClO-+Cl- K=10-10.9 |
| B、在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-) |
| C、用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 |
| D、氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
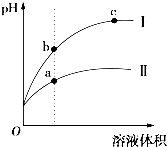 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示.据图判断不正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示.据图判断不正确的是( )| A、I是盐酸,Ⅱ是醋酸 |
| B、溶液的导电性a>b>c |
| C、a、b、c三点KW的数值相同 |
| D、稀释前等体积的 I、Ⅱ溶液中和氢氧化钠的能力相同 |