题目内容
6.在一密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )| A. | SO2为0.4mol/L、O2为0.2mol/L | B. | SO3为0.4mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.25mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:2SO2(g)+O2(g)?2SO3(g),
某时刻 0.2mol/L 0.1mol/L 0.2mol/L
极限转化 0.4mol/L 0.2mol/L 0
极限转化 0 0 0.4mol/L
A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度分别为0.4mol/L、0.2mol/L,三氧化硫不可能完全转化,故A错误;
B、SO3为0.4mol/L,SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度为0.4mol/L,达到平衡的实际浓度应该小于0.4mol/L,故B错误;
C、反应物、生产物的浓度不可能同时减小,只能一个减小,另一个增大,故C错误;
D、SO2为0.25mol/L,SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度为0.4mol/L,实际浓度为0.25mol/L小于0.4mol/L,故D正确;
故选D.
点评 本题考查可逆反应,注意可逆反应的特点为不完全转化性,学生应学会利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,难度不大.

练习册系列答案
相关题目
17.可逆反应:2NO2?2NO+O2在恒容容器中反应,可判断该反应达平衡状态的是( )
| A. | 单位时间内生成n mo1 O2的同时生成n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均密度不再改变的状态 |
11.关于维生素的下列说法不正确的是( )
| A. | 维生素是生物生长发育和新陈代谢所必需的物质 | |
| B. | 按溶解性的不同,维生素可分为脂溶性维生素和水溶性维生素两类 | |
| C. | 维生素可为人体提供能量 | |
| D. | 脂溶性维生素不易排泄,容易在体内积存,主要积存在肝脏中 |
18.下列说法不正确的是( )
| A. | 葡萄糖在一定条件下可发生银镜反应 | |
| B. | 蔗糖和麦芽糖互为同分异构体 | |
| C. | 淀粉和纤维素互为同分异构体 | |
| D. | 油脂在体内酶的催化下水解得高级脂肪酸和甘油 |
15.已知在一容器中发生反应:Fe+Cu2+═Fe2++Cu,有关说法正确的是( )
| A. | 可能为电解池反应,Fe做阴极,CuSO4溶液做电解液 | |
| B. | 可能为原电池反应,负极Fe被还原为Fe2+ | |
| C. | 可能为电解池反应,阳极反应:Fe-2e-═Fe2+ | |
| D. | 可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液 |
13.下列说法中正确的是( )
| A. | 含1 mol Na2CO3的溶液中有Na+的个数为NA | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | CH4的摩尔质量为16g | |
| D. | 3.01×1023个SO2分子的质量为32g |

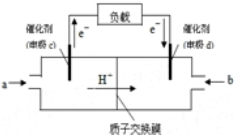 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.