题目内容
13.下列说法中正确的是( )| A. | 含1 mol Na2CO3的溶液中有Na+的个数为NA | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | CH4的摩尔质量为16g | |
| D. | 3.01×1023个SO2分子的质量为32g |
分析 A、1 mol Na2CO3中含有2mol的钠离子;
B、气体摩尔体积只适用于气体;
C、摩尔质量的单位是g/mol;
D、n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$进行计算求解.
解答 解:A、1 mol Na2CO3中含有2mol的钠离子,所以1 mol Na2CO3的溶液中有Na+的个数为2NA,故A错误;
B、气体摩尔体积只适用于气体,所以标准状况下,1 mol气体物质体积均为22.4L,故B错误;
C、摩尔质量的单位是g/mol,所以CH4的摩尔质量为16g/mol,故C错误;
D、3.01×1023个SO2分子的物质的量为:$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,所以质量为0.5mol×64g/mol=32g,故D正确;
故选D.
点评 本题考查物质的量的相关计算,学生只要掌握物质的量为中心的相关量的换算,特别是气体摩尔体积使用的对象必须是气体,比较容易.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
6.在一密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A. | SO2为0.4mol/L、O2为0.2mol/L | B. | SO3为0.4mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.25mol/L |
4.用下列实验装置进行相应实验,能达到实验目的是( )
| A. |  用如图所示装置,制备并收集少量NO2气体 | |
| B. |  用如图所示装置,除去CO2中的HCl | |
| C. |  用图所示装置,制备Fe(OH)2并能较长时间观察其颜色 | |
| D. |  用图所示装置,所示装置制取并收集干燥纯净的NH3 |
1.下列实验操作正确的是( )
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10 mL量筒量取8.58 mL蒸馏水 | |
| C. | 配制5%的食盐溶液时,将称量好的食盐放入烧杯中加适量的水搅拌溶解 | |
| D. | 稀释浓硫酸溶液时,将量取的浓硫酸放入烧杯中加水稀释 |
18.对于3Cl2+6NaOH═5NaCl+NaClO3+3H2O的反应,下列说法中不正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的氯原子个数与被还原的氯原子个数比是1:5 | |
| C. | Cl2既是氧化剂,又是还原剂 | |
| D. | 得电子的氯原子个数与失电子的氯原子个数之比为5:1 |
5.分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )
| A. | 根据是否含氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
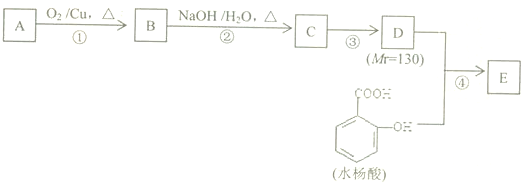
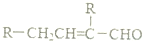
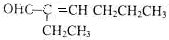 ,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键.
,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键. .
.