题目内容
16.NO2可电解制备绿色硝化试剂N2O5,其原理如图所示,下列说法错误的是( )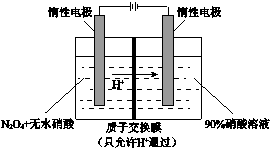
| A. | 阳极电解液中的N2O4可由NO2降温转化制得 | |
| B. | 阳极的电极反应为:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| C. | 阴极的电极反应为:2H++2e-=H2↑ | |
| D. | 每制备1molN2O5,有1molH+通过质子交换膜 |
分析 A.NO2(g)?N2O4(g)△H<0;
B.阳极上N2O4失电子生成N2O5;
C.阴极上氢离子得电子生成氢气;
D.根据电极方程式结合电荷守恒分析.
解答 解:A.NO2(g)?N2O4(g)△H<0,降低温度向吸热方向移动,即降低温度向生成N2O4的方向移动,故A正确;
B.阳极上N2O4失电子生成N2O5,则阳极电极方程式为:N2O4-2e-+2HNO3=2N2O5+2H+,故B正确;
C.阴极上氢离子得电子生成氢气,则阴极上电极方程式为:2H++2e-=H2↑;
D.已知阳极电极方程式为:N2O4-2e-+2HNO3=2N2O5+2H+,阴极上电极方程式为:2H++2e-=H2↑,则每制备1molN2O5,转移2mol电子,所以溶液中有2molH+通过质子交换膜,故D错误.
故选D.
点评 本题主要考查电解池的工作原理,注意阳极发生氧化反应,阴极发生还原反应,题目难度中等,明确电解池中电极的判断以及电极方程式的书写是解题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.维生素C的结构简式如图所示.则有关它的叙述错误的是( )


| A. | 易起氧化及加成反应 | B. | 在碱性溶液中不能稳定地存在 | ||
| C. | 难溶解于水 | D. | 是一个环状的酯类化合物 |
7.下列各组物质中,化学键类型和化合物类型都相同的是( )
| A. | KOH和NaCl | B. | NaCl和HCl | C. | CO2和Na2CO3 | D. | SO2和H2O |
4.下列化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2=CH2 | B. | 醋酸的分子式:CH3COOH | ||
| C. | 丙烷的比例模型: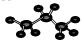 | D. | 乙酸甲酯的结构式:CH3COOCH3 |
11.下列有关Ca(ClO)2溶液的叙述不正确的是( )
| A. | 该溶液中Na+、K+、NO${\;}_{3}^{-}$、Cl-可大量共存 | |
| B. | 向溶液中通入CO2气体可以增强溶液漂白性 | |
| C. | 和浓盐酸反应的离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O | |
| D. | 通入过量SO2气体反应的离子方程式:SO2+ClO-+Ca2++H2O=CaSO4↓+Cl-+2H+ |
1.下列说法不正确的是( )
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 沼气的利用,玉米制乙醇都涉及生物质能的利用 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | pH计可用于酸碱中和滴定终点和乙酸乙酯的水解程度的判断 |
20.下列食品的制作过程中,没有发生化学变化的是( )
| A. | 鲜奶制酸奶 | B. | 黄豆磨豆浆 | C. | 葡萄酿制酒 | D. | 面团发酵做馒头 |
1.下列操作正确的是( )
| A. | 锥形瓶在装待测液前要用待测液润洗2~3次 | |
| B. | 用25mL酸式滴定管量取20.00mLKMnO4溶液 | |
| C. | 测某溶液pH:用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测 | |
| D. | 加热蒸发NaHCO3溶液得纯净的NaHCO3 |