题目内容
11.下列有关Ca(ClO)2溶液的叙述不正确的是( )| A. | 该溶液中Na+、K+、NO${\;}_{3}^{-}$、Cl-可大量共存 | |
| B. | 向溶液中通入CO2气体可以增强溶液漂白性 | |
| C. | 和浓盐酸反应的离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O | |
| D. | 通入过量SO2气体反应的离子方程式:SO2+ClO-+Ca2++H2O=CaSO4↓+Cl-+2H+ |
分析 A.离子之间发生反应的不能大量共存;
B.次氯酸具有漂白性,次氯酸的含量越大该溶液的漂白性越强;
C.次氯酸根离子和浓盐酸发生氧化还原反应生成氯气;
D.次氯酸钙和过量二氧化硫发生氧化还原反应生成硫酸钙和盐酸、硫酸.
解答 解:A.离子之间发生反应的不能大量共存,这几种离子之间不反应且和次氯酸钙不反应,所以能大量共存,故A正确;
B.次氯酸具有漂白性,次氯酸的含量越大该溶液的漂白性越强,通入二氧化碳后生成次氯酸,次氯酸含量增大导致溶液漂白性增强,故B正确;
C.次氯酸根离子和浓盐酸发生氧化还原反应生成氯气,离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O,故C正确;
D.次氯酸钙和过量二氧化硫发生氧化还原反应生成硫酸钙和盐酸、硫酸,离子方程式为Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,故D错误;
故选D.
点评 本题以离子共存、离子方程式正误判断为载体考查氧化还原反应,为高频考点,明确离子性质、氧化还原反应原理是解本题关键,注意D发生的反应与反应物的量有关,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列反应中,与其它三个反应不属于同一类型的反应是( )
| A. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$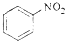 +H2O +H2O | |
| B. | CH2═CH2+Br2→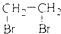 | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2 $\stackrel{光}{→}$ CH3Cl+HCl |
6.将甘氨酸和丙氨酸混合反应生成各种二肽,可能的连接方式有多少种?( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
16.NO2可电解制备绿色硝化试剂N2O5,其原理如图所示,下列说法错误的是( )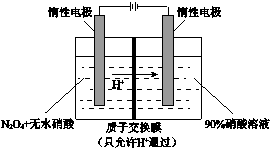

| A. | 阳极电解液中的N2O4可由NO2降温转化制得 | |
| B. | 阳极的电极反应为:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| C. | 阴极的电极反应为:2H++2e-=H2↑ | |
| D. | 每制备1molN2O5,有1molH+通过质子交换膜 |
16.下列离子方程式正确的是( )
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 金属钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| C. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
 甲醇(CH3OH)是一种常见有机物,有重要的应用.
甲醇(CH3OH)是一种常见有机物,有重要的应用.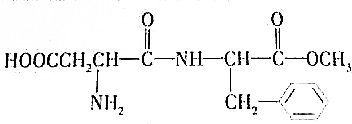

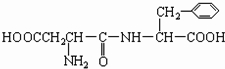 和CH3OH(填结构简式)
和CH3OH(填结构简式) 、
、 和甲醇.
和甲醇. (填结构简式,该分子中除苯环以外,还含有一个6原子组成的环)
(填结构简式,该分子中除苯环以外,还含有一个6原子组成的环) .
.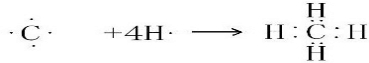 .
.