题目内容
8.已知四种短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同电子层结构,则下列叙述不正确的是( )| A. | 原子半径 B>A>C>D | B. | 最高价氧化物水化物的碱性B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 氢化物的稳定性 C>D |
分析 aA2+、bB+、cC3-、dD-都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数A>B,C、D在上一周期,为非金属元素,且原子序数D>C,以此来解答.
解答 解:aA2+、bB+、cC3-、dD-都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数A>B,C、D在上一周期,为非金属元素,且原子序数D>C,
A.电子层越多,半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故A正确;
B.由A、B在下一周期,为金属元素,且原子序数A>B,则金属性B>A,所以最高价氧化物水化物的碱性为B>A,故B正确;
C.具有相同电子排布的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3->D->B+>A2+,故C正确;
D.由C、D在上一周期,为非金属元素,且原子序数D>C,则非金属性D>C,所以氢化物的稳定性D>C,故D错误;
故选:D.
点评 本题考查原子结构与元素周期律的关系,为高频考点,侧重于学生的分析能力的考查,明确离子具有相同的电子排布推出元素的位置是解答本题的关键,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
4.关于分散系的说法,正确的是( )
| A. | 根据体系的稳定性,可将分散系分为溶液、胶体和浊液 | |
| B. | 一种分散系的分散质可以是固态、液态或气态,但只能是纯净物 | |
| C. | 利用丁达尔效应可以区分溶液和胶体,它利用了光的衍射原理 | |
| D. | 火力发电厂的烟气管道里安装的静电除尘装置,它利用了胶体的电泳原理 |
19.只用水不能鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙酸乙酯和乙醇 | C. | 苯和四氯化碳 | D. | 苯和乙酸 |
16.“天宫一号”使用镍氢电池供电.镍氢电池的负极材料为储氢合金(用-表示,氢以单原子填入合金晶格),总反应为M+Ni(OH)2$?_{放电}^{充电}$MH+NiOOH,下列说法正确的是( )
| A. | 电池充电时氢原子被氧化 | |
| B. | 电池放电时正极为NiOOH | |
| C. | 电池充电时,与电源负极相连的电极反应为:MH+OH--e-═M+H2O | |
| D. | 电池放电时,负极反应为:Ni(OH)2+OH--e-=NiOOH+H2O |
13.下列反应中转移电子的物质的量不等于2mol的是( )
| A. | 1 mol Al与含1mol H2SO4的稀硫酸溶液反应 | |
| B. | 1mol Cu与含4mol HNO3的浓硝酸溶液反应 | |
| C. | 1 mol Cu与含2 mol H2SO4的浓硫酸共热 | |
| D. | 1 mol MnO2与足量浓盐酸共热 |
17.除去FeCl3溶液中混有的少量FeCl2,可以向此溶液中通入过量的氯气,发生如下反应:2FeCl2+Cl2═2FeCl3.对于该反应说法正确的是( )
| A. | 属于氧化还原反应 | B. | 属于复分解反应 | ||
| C. | Cl2作还原剂 | D. | Fe2+被还原 |


 $\stackrel{NaOH溶液,△}{→}$CH3COONa+
$\stackrel{NaOH溶液,△}{→}$CH3COONa+ -ONa)
-ONa)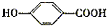 .
. 或
或 .
. ,反应类型是消去反应.
,反应类型是消去反应.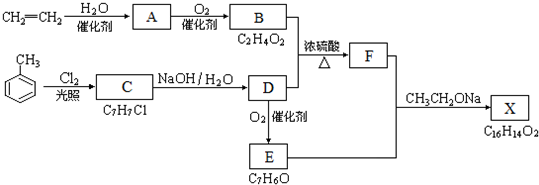
 ;
; ;
;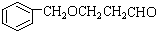 B、
B、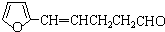
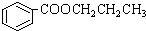
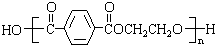 ,其合成单体为
,其合成单体为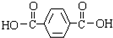 和HOCH2CH2OH;
和HOCH2CH2OH;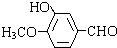 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.