题目内容
1.实验中的下列操作叙述正确的是( )| A. | 蒸馏时沸石的作用是防止液体受热时突然沸腾(爆沸) | |
| B. | 蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 | |
| D. | 用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容 |
分析 A.液体加热通常加热沸石防止暴沸;
B.温度计测量的是蒸汽的温度,应该放在蒸馏烧瓶的支管口处;
C.溶液蒸发结晶剩余液体利用余热蒸干;
D.稀释浓硫酸应该在烧杯中进行,不能直接在容量瓶中稀释浓硫酸.
解答 解:A.液体加热通常加热沸石以防止液体受热时突然沸腾,故A正确;
B.蒸馏操作中,温度计测量的是蒸汽的温度,温度计水银球应在蒸馏烧瓶支管口处,故B错误;
C.用蒸发方法使NaCl从溶液中析出时,蒸发时待蒸发皿中出现较多量固体时停止加热,若水分全部蒸干,固体会受热不均向外迸溅,所以利用余热蒸干,故C错误;
D.稀释浓硫酸应该在烧杯中进行,如果浓硫酸直接转移至容量瓶后再加水定容,浓硫酸稀释放出大量的热,冷却到室温导致溶液体积偏小,所配溶液浓度偏大,且容量瓶受热不均,可能导致容量瓶破裂,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,涉及浓硫酸的稀释操作、溶液配制、蒸发、蒸馏等知识,明确常见化学实验基本操作方法为解答关键,试题侧重考查学生的分析能力及化学实验能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
11.下列属于离子化合物的是( )
| A. | HCl | B. | N2 | C. | AlCl3 | D. | NH4Cl |
12.X、Y、Z三种物质均含某种元素,箭头表示物质间的转化一步就能实现,则X不可能是( )


| A. | SiO2 | B. | CO2 | C. | Na | D. | HNO3 |
9.下列操作可得纯净Al2O3的是( )
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
16.已知酸性条件下有如下反应:2Cu+═Cu2++Cu.由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
由此推出本次氢气还原氧化铜实验的产物是( )
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
6.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 汽油 | 苛性钾 | 碳酸氢钠 | 乙醇 |
| C | 烧碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | H2O | NH3 |
| A. | A | B. | B | C. | C | D. | D |
13.A~K为中学化学的常见物质,他们之间有如图所示的转化关系.(其中部分反应产物和反应条件已略去).已知,通常状况下,A是一种黄绿色的非金属单质;B是一种有刺激性气味的气体,且有漂白性.C和D是中学化学中常见的两种强酸,I和J不溶于水也不溶于稀硝酸;K为金属单质.
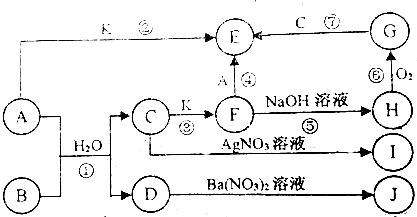
回答下列问题:
(1)写出物质B和I的化学式:BSO2,IAgCl.
(2)反应④的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
(3)反应⑥的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)检验E中阳离子的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)对气体A进行如下检验,已知整个反应过程中,每消耗0.1molKI,转移电子数3.612×1023个.按要求填空.

回答下列问题:
(1)写出物质B和I的化学式:BSO2,IAgCl.
(2)反应④的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
(3)反应⑥的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)检验E中阳离子的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)对气体A进行如下检验,已知整个反应过程中,每消耗0.1molKI,转移电子数3.612×1023个.按要求填空.
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |
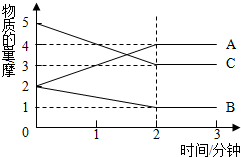 在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.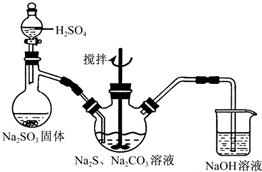 硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.